INTRODUÇÃO
A isquemia/reperfusão (IR) pulmonar apresenta intensa resposta inflamatória, com infiltração de neutrófilos nos pulmões, lesão endotelial dos microvasos e edema pulmonar. Além disso, a IR resulta em excessiva produção de espécies reativas de oxigênio e redução na produção ou disponibilidade do óxido nítrico, causando efeitos deletérios aos tecidos. O exercício físico aeróbio de moderada intensidade promove efeitos benéficos tanto na prevenção quanto no tratamento de diversas doenças, como hipertensão arterial, diabetes mellitus e aterosclerose. No entanto, o papel do exercício como protetor das doenças inflamatórias, e mais especificamente das doenças pulmonares relacionadas ao processo de IR, ainda necessita de mais estudos. Recentes pesquisas em nosso laboratório usando modelos experimentais de IR pulmonar demonstraram que o treinamento físico prévio ao processo cirúrgico, de moderada intensidade, promove efeitos benéficos significativos [1-3]. Portanto, o treinamento físico aeróbio pode ser de grande relevância tanto na redução de comorbidades como prevenção das complicações pós-cirúrgicas associadas ao processo de IR pulmonar.
Essa revisão baseou-se em pesquisa bibliográfica de artigos científicos em inglês e português nas bases de dados SciELO e MEDLINE (de 1987 até 2008) e também de textos clássicos relacionados ao tema. A estratégia de busca primária envolveu o cruzamento das seguintes palavras chaves: isquemia, reperfusão, isquemia/reperfusão pulmonar, resposta inflamatória, espécies reativas de oxigênio, estresse oxidativo, defesa antioxidante e exercício físico. Também foi realizada uma pesquisa secundária envolvendo a lista de referências dos artigos identificados na busca primária.
ISQUEMIA/REPERFUSÃO E COMPLICAÇÕES PULMONARES
Um dos quadros que acarretam maiores complicações após as cirurgias cardiotorácicas é o processo de IR, que provoca intensa resposta inflamatória, acarretando graves complicações e disfunção pulmonar. A lesão aguda de reperfusão tornou-se fator importante de morbidade na cirurgia cardiotorácica, com impactos significantes nas despesas e cuidados com a saúde. Além disso, a Sociedade Internacional de Transplantes de Coração e Pulmão demonstrou que os fatores de riscos mais significativos para o desenvolvimento de complicações pós-operatórias ou de mortes para indivíduos transplantados são: idade do doador e tempo de isquemia do órgão [4]. Embora existam consideráveis avanços na área da imunologia dos transplantes, a lesão aguda de reperfusão ou a resposta de reimplante permanecem como fonte de considerável morbidade, o reconhecimento, o diagnóstico e a gerência das complicações pós-operatórias ainda necessitam de avanços [5].
A integridade das células endoteliais e da musculatura lisa vascular é de fundamental importância na manutenção da perfusão alveolar para a fisiologia pulmonar, no que se refere às trocas gasosas e homeostase do organismo. Os vasos sanguíneos, usualmente, possuem três camadas: a camada íntima, que está em contato com os elementos do sangue, e é essencialmente constituída por células endoteliais; a camada média, composta de células musculares lisas; e a camada adventícia, composta de tecido conjuntivo fibroso, e reveste a parte externa do vaso. As células endoteliais são responsáveis pela síntese, pelo metabolismo e pela liberação de grande variedade de mediadores que regulam o tônus vascular, a permeabilidade vascular, o metabolismo de substâncias endógenas e exógenas, e a atividade plaquetária e leucocitária. As substâncias produzidas pelo endotélio podem ser divididas entre agentes vasodilatadores, como prostaciclina (PGI
2), óxido nítrico (NO) e fator hiperpolarizante derivado do endotélio (EDHF), e agentes vasoconstritores, como endotelinas, prostaglandina H2 (PGH2), tromboxano A2 (TXA
2) e as espécies reativas de oxigênio (EROs) [6]. Dentre essa variedade de substâncias, o NO merece atenção especial devido ao seu papel no mecanismo de vasodilatação e neutralizador das EROS. Enzimas conhecidas como sintases do NO (NOS), as quais são divididas em dois grandes grupos isoformas constitutivas (cNOS: eNOS-endotelial e nNOS-neuronal), e isoforma indizível (iNOS), são capazes de catalisar a oxidação do nitrogênio terminal do grupamento guanidino da L-arginina, formando NO e L-citrulina. Uma vez liberado, o NO promove diversas ações no sistema cardiovascular, entre elas inibição da agregação plaquetária, vasodilatação, inibição de crescimento celular e da resposta inflamatória e neutralização das EROS [7]. Além disso, as células endoteliais presentes nos vasos dos pulmões têm importante papel na síntese e na degradação de substâncias presentes no sangue, como a angiotensina e a bradicinina [6].
Alterações funcionais vasculares associadas ao processo de IR podem estar envolvidas nas complicações pulmonares relacionadas ao desenvolvimento de diversas doenças, como a hipertensão arterial pulmonar (HAP) e a síndrome da angústia respiratória aguda (SARA). A HAP é definida como elevação da pressão média da artéria pulmonar maior que 25 mmHg (repouso) ou maior que 30 mmHg (exercício), com pressão de oclusão da artéria pulmonar menor que 15 mmHg [8] e é considerada uma situação clínica de elevada gravidade. É sabido que a lesão e/ou disfunção das células endoteliais está relacionada ao desenvolvimento da HAP, ao desbalanço entre os mediadores vasodilatadores e vasoconstritores, incluindo a diminuição na produção de PGI
2 e NO e aumento na produção de endotelina (ET-1) e TXA
2 [9]. A lesão endotelial inicial resulta em recrutamento de mediadores vasoativos locais, promovendo um estado pró-coagulante, levando a consequente obstrução vascular. Além disso, defeitos nos canais de potássio da musculatura lisa da circulação pulmonar parecem estar envolvidos no início e/ou progressão da HAP [10].
A síndrome da angústia respiratória aguda (SARA) é considerada a disfunção respiratória mais grave [5,11]. A SARA é descrita como um quadro de lesão pulmonar aguda, associada a um edema pulmonar agudo, não hidrostático ou não cardiogênico, acompanhado de uma hipoxemia grave, responsável por altas taxas de mortalidade. Caracteriza-se por dano do endotélio e do epitélio pulmonar, com consequente lesão da membrana alvéolo-capilar. Existem muitos mediadores que são imputados como causadores e perpetuadores da síndrome, mas, em geral, sua patogênese consiste de duas vias: os efeitos diretos da lesão nas células pulmonares e uma resposta inflamatória sistêmica aguda, que pode incluir componentes celulares e humorais. Apesar da SARA ter sido descrita há mais de 30 anos, várias dúvidas ainda persistem quanto à sua definição, fisiologia, fisiopatologia e tratamento [12-14].
A lesão de IR pulmonar constitui importante evento fisiopatológico comum a diversas situações na prática clínica. Seus efeitos locais e sistêmicos podem ser estudados em condições que envolvem o transplante pulmonar, cirurgia cardiotorácica, oclusão da artéria pulmonar, tromboembolismo pulmonar, pneumotórax total e derrame pleural volumoso [15]. A isquemia é caracterizada pela interrupção no suprimento de oxigênio e nutrientes para uma determinada área, induz à disfunção tecidual e, dependendo do grau de isquemia, pode gerar a morte de tecidos. Os danos teciduais dependem das características do tecido envolvido, capacidade de recrutamento capilar na microcirculação, demanda metabólica, estoques de oxigênio disponíveis, e a capacidade de produção de energia por metabolismo anaeróbio. A lesão por IR pode ser definida como o dano que ocorre em determinado tecido com a restauração do fluxo sanguíneo, após o período de isquemia [16-18].
Evidências mostram que a lesão dos tecidos não está limitada somente à isquemia, mas que durante ou após a reperfusão o comprometimento tecidual é também de grande relevância clínica. A reperfusão pode lesar isoladamente o órgão isquemiado, como ocorre nos transplantes de órgãos ou pode se estender para outros órgãos, em função de uma resposta inflamatória sistêmica, na qual mediadores inflamatórios são produzidos e liberados na circulação, alcançando diferentes órgãos [19-21].
A isquemia pulmonar ocorrida como resultado da oclusão da artéria pulmonar seguida de reperfusão está associada à infiltração de neutrófilos nos pulmões, lesão endotelial dos microvasos e edema pulmonar [22,23]. As EROs derivadas dos neutrófilos podem levar ao dano tecidual e vascular por meio da aderência de neutrófilos polimorfonucleares nas células endoteliais [20,24]. Conjuntamente, a resposta celular envolve neutrófilos, macrófagos/monócitos e linfócitos, os quais têm um papel importante no processo que inclui a adesão, a quimiotaxia e a ativação desses leucócitos [14,16]. Essa interação intercelular é feita por moléculas de adesão (adesinas, integrinas e selectinas), presentes nas células endoteliais e inflamatórias [25]. Os eventos envolvidos na resposta inflamatória sistêmica incluem alterações plasmáticas, como ativação do sistema complemento, coagulação/fibrinólise e cininas, aumento dos mediadores pró-inflamatórios; citocinas como fator de necrose tumoral á (TNF-a), interleucina 1ß (IL-1ß), interleucina 6 (IL-6), interleucina 8 (IL-8), mediadores lipídicos oxidantes, proteases, óxido nítrico e neuropeptídeo e indução de síntese protéica. Esses fatores são considerados responsáveis pela injúria celular e alterações no surfactante (importante substância que atua na redução da tensão superficial dos líquidos que revestem o interior dos alvéolos e demais vias respiratórias), com distúrbio da relação ventilação/perfusão, resultando em hipoxemia [26]. Comumente, a IR corresponde à anóxia-reoxigenação nos órgãos transplantados, contudo, os pulmões são considerados diferentes, pois contêm oxigênio nos alvéolos durante a isquemia. Por isso, nos pulmões, o estresse oxidativo resultante da isquemia deve ser distinguido daquele resultante de outros órgãos [18,27,28].
RESPOSTA INFLAMATÓRIA NO PROCESSO DE ISQUEMIA/REPERFUSÃO
As citocinas compreendem um grande número de glicoproteínas de baixo peso molecular, que atuam na intercomunicação celular. Os aspectos mais importantes dessas proteínas são seu amplo espectro e seu potencial de ação. Podem ser produzidas por qualquer célula do corpo, com exceção dos eritrócitos, e estão relacionadas à estimulação e à supressão dos eventos da resposta imune, desencadeando e coordenando a resposta inflamatória [29].
A resposta inflamatória que pode levar à disfunção e à falência de um determinado órgão é um dos maiores problemas após a ocorrência de lesões em diferentes condições, como na sepse, queimaduras graves, pancreatite aguda, choque hemorrágico, trauma e transplantes [30,31]. Sabe-se que as citocinas pró-inflamatórias desempenham um papel importante na lesão de IR do coração, rim, intestino delgado, pele e fígado, mas pouco se sabe sobre o papel delas na lesão de IR pulmonar [32].
Uma importante citocina liberada durante o processo de IR é o TNF-a. Essa citocina, além de possuir um efeito citotóxico direto no endotélio, estimula a produção de outras citocinas, como as interleucinas (IL). Essas substâncias interagem com as células endoteliais, aumentando a atividade pró-coagulante e a produção do inibidor do plasminogênio, facilitando a coagulação e promovendo a ativação de neutrófilos, monócitos e linfócitos que, por sua vez, liberam ânions superóxido (O
2-) e outras EROs que participam no processo de lesão do tecido endotelial [31]. Estudos evidenciam que o TNF-a altera a seletividade da barreira endotelial e produz edema pulmonar em modelos experimentais, o TNF-a aumenta a resistência vascular pulmonar, o que resulta em edema alveolar, sendo um resultado da liberação de tromboxano A
2 (TXA
2) em resposta à ativação de leucócitos polimorfonucleares [33,34].
Outra interleucina importante na resposta inflamatória ligada a IR é a IL-1ß, caracterizada também como pró-inflamatória, está ligada à ativação de neutrófilos e induz à ligação das moléculas de adesão aos leucócitos e ao endotélio. A IL-1ß induz a ação da cicloxigenase (COX) e a expressão da óxido nítrico sintase induzível (iNOS). Ela também eleva a expressão de outras citocinas tais como TNF-a, IL-6 e as moléculas de adesão [35]. A COX é uma importante enzima presente nas membranas celulares, que produz os prostanóides a partir do ácido araquidônico, pode ser dividida em dois subtipos, COX-1 e COX-2; mais especificamente, a COX-2 está associada à resposta inflamatória e produção de importantes mediadores, como as citocinas [36].
A IL-6 possui importante papel na resposta inflamatória aguda e é produzida por diferentes tipos de células, como monócitos, fibroblastos e células endoteliais, sendo os principais estímulos para a produção de IL-6, os lipopolissacarídeos, IL-1 e o TNF-a. Inicialmente acreditava-se que a IL-6 possuía apenas papel pró-inflamatório, mas recentes estudos sugerem também papel antiinflamatório, sendo muito importante para o retorno da homeostasia após o processo inflamatório. Concentrações plasmáticas elevadas de IL-6 têm sido constatadas em diversas condições nas quais a homeostasia do sistema está comprometida ou ameaçada, tais como sepse ou múltiplos traumas [37,38]. O papel da IL-6 no transplante pulmonar ainda não está muito bem estabelecido e existem resultados conflitantes. No entanto, níveis elevados de IL-6 foram constatados na lesão das vias respiratórias e tecido pulmonar após estímulos inflamatórios, mas a relevância funcional desses achados ainda não está clara [39,40].
ESTRESSE OXIDATIVO E ESPÉCIES REATIVAS DE OXIGÊNIO
Diversos autores têm demonstrado direta associação entre o aumento na produção de espécies reativas de oxigênio (EROs) e diversas patologias humanas, entre elas o acidente vascular cerebral, o infarto do miocárdio, a aterosclerose, a lesão de IR e a artrite reumatóide, e no próprio envelhecimento [41-43]. Além disso, as EROs têm importante papel na SARA e na lesão pulmonar e vascular após o processo de IR pulmonar [44]. Particularmente, os neutrófilos aderidos ao endotélio vascular pulmonar durante IR pulmonar participam do dano tecidual por meio da produção de EROs [26,45].
O estresse oxidativo envolve a produção de EROs por diferentes células do organismo, como as células endoteliais, a célula muscular lisa, as células da camada adventícia, células do sistema imunológico, entre outras. As EROs são formadas por atividade enzimática intra e extracelular, sendo a xantina oxidase, o citocromo P450, a via da cicloxigenase, a óxido nítrico sintase endotelial (eNOS) desacoplada e a NADPH oxidase, as principais enzimas envolvidas nesse processo. A NADPH oxidase é a principal enzima formadora de ânion superóxido (O
2-) que possui grande citotoxicidade e está envolvida na gênese da lesão de IR pulmonar [46-48].
A NADPH oxidase é uma enzima envolvendo diversas subunidades, como a p22
phox e gp91
phox (Nox2), p47
phox, p67
phox, p40
phox, e uma pequena guanosina-trifosfato (GTP)-ligada proteina Rac [48,49]. Esse complexo está envolvido na produção de O
2-. A enzima eNOS desacoplada também pode ser uma importante fonte de O
2- e esta produção ocorre quando a biodisponibilidade de L-arginina ou de (6R)-5,6,7,8-tetraidrobiopterina (BH
4), substratos para a formação de óxido nítrico (NO), apresentam-se em concentrações reduzidas [50]. A reação do O
2- com o NO produzido pela célula endotelial reduz a sua biodisponibilidade, dando origem a uma molécula altamente instável, o peroxinitrito (OONO-), capaz de oxidar proteínas, lipídios e ácidos nucléicos, provocando danos celulares por meio da ativação do fator nuclear kappa B (NF-kB), fatores de crescimento, e de citocinas, que por sua vez desencadeiam alterações estruturais e funcionais, como o remodelamento vascular, aumento da deposição de proteínas da matriz extracelular, aumento do processo inflamatório e da permeabilidade endotelial nos tecidos envolvidos [51].
As enzimas antioxidantes compõem a principal linha de defesa aos componentes oxidantes do sistema. Dentre as enzimas antioxidantes presentes no tecido vascular, temos a catalase (CAT), a glutationa peroxidade (GSH-Px) e mais três tipos de superóxido dismutase (SOD), sendo a SOD-1 dependente de Cu/Zn, presente no núcleo e no citosol, a SOD-2 dependente de Mn, presente na mitocôndria e a SOD-3 dependente de Cu/Zn, presente na matriz extracelular. Na enzima SOD, seu sistema parece ser específico para a dismutação do O
2-, formando assim peróxido de hidrogênio (H
2O
2). A CAT e a GSH-Px desempenham importante papel na eliminação de H
2O
2, promovendo, assim, a formação de água. O perfeito equilíbrio entre as enzimas antioxidantes é importante para a manutenção da integridade celular, pois a SOD, CAT e GSH-Px evitam o acúmulo de O
2- e H
2O
2, evitando o dano celular [52] (Figura 1).
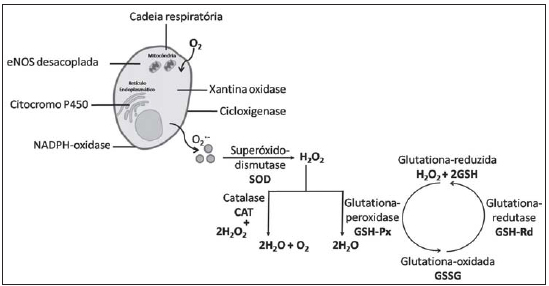
Fig. 1 - Sistema enzimático oxidante e antioxidante. eNOS = óxido nítrico sintase endotelial; O2+- = ânion superóxido; H2O2 = peróxido de hidrogênio). Adaptado de Fortuño et al. [48] e Ray & Shah [49]
O exercício físico é uma atividade realizada com repetições sistemáticas de movimentos orientados, com consequente aumento no consumo de oxigênio devido à solicitação muscular. O exercício físico provoca uma série de respostas fisiológicas nos sistemas corporais e, em especial, no sistema cardiovascular, com o objetivo de manter o equilíbrio celular em face ao aumento das demandas metabólicas e do consumo de energia [53,54]. Sabe-se que o exercício físico aeróbio de moderada intensidade, realizado continuamente, promove efeitos benéficos tanto na prevenção quanto no tratamento das doenças cardiovasculares, e sua prática regular tem sido recomendada por diferentes associações de saúde do mundo. Seus benefícios também têm sido demonstrados na prevenção e no tratamento da hipertensão arterial, diabetes mellitus, dislipidemia, obesidade e osteoporose. Sendo assim, o baixo nível de atividade física ou de condicionamento físico são considerados fatores de risco para o desenvolvimento dessas doenças [55-57].
Esses benefícios estão relacionados ao aumento na produção de substâncias vasoativas, como o NO, e/ou ao aumento de sua disponibilidade nas células endoteliais [58-60]. Sabe-se que o exercício físico aumenta o fluxo sanguíneo pulsátil e a pressão que o sangue exerce sobre a parede vascular e a força de cisalhamento sobre as células endoteliais são estímulos poderosos para a geração de NO no sistema vascular. Assim, um dos efeitos benéficos do exercício físico regular está estreitamente relacionado à sua capacidade de estimular a síntese de NO pelas células endoteliais [61,62]. Outra modificação vascular provocada pelo exercício físico está relacionada à expressão e à atividade de enzimas antioxidantes. Destas enzimas, a SOD-1 Cu/Zn é a mais sensível à força de cisalhamento provocado pelo exercício físico [63].
No entanto, poucos estudos existem relacionando o papel crônico do exercício físico como protetor das doenças inflamatórias, e mais especificamente das doenças pulmonares associadas à lesão de IR pulmonar. A resposta das citocinas ao exercício agudo difere daquela vista na lesão de IR. Nota-se que as clássicas citocinas pró-inflamatórias, TNF-a e IL-1ß, em geral não se elevam com o exercício físico, indicando que a cascata de citocinas induzidas pelo exercício físico difere da cascata induzida pela IR [64,65]. Recentes estudos realizados em nosso laboratório usando modelos experimentais demonstraram que o treinamento físico aeróbio de moderada intensidade prévio ao processo de IR pulmonar promove atenuação do extravasamento de proteínas nos pulmões, com diminuição da permeabilidade vascular e, consequentemente, do edema pulmonar. O treinamento físico também promoveu a diminuição dos níveis plasmáticos de TNF-a e IL-1ß, aumento da atividade plasmática da enzima antioxidante SOD neste modelo experimental [2]. Mais recentemente, observamos que o exercício físico promove redução da superexpressão da subunidade citosólica da NADPH oxidase p47
phox desencadeada pela IR pulmonar em artéria mesentérica de ratos [3]. Todos esses dados evidenciam os efeitos benéficos do treinamento físico na prevenção das respostas inflamatórias antes do processo de IR pulmonar, bem como elevação da defesa antioxidante, importante para o controle das EROs. Foi demonstrado também que a IR pulmonar provoca alterações vasculares e inflamatórias locais e sistêmicas no organismo e o exercício físico colaborou no controle dessas alterações em nível sistêmico [1-3] (Figura 2).
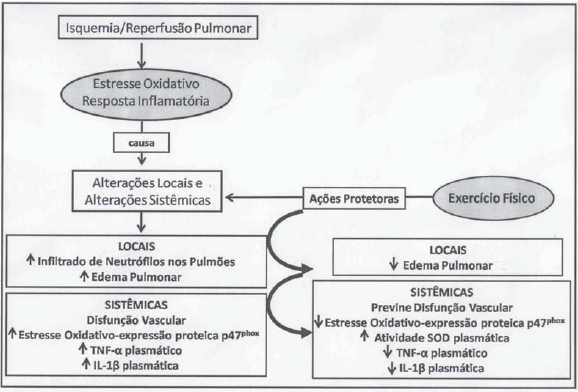
Fig. 2 - Efeitos do treinamento físico aeróbio de moderada intensidade prévio ao processo de IR pulmonar. TNF-a = fator de necrose tumoral a; IL-1b = interleucina 1b ; SOD = superóxido dismutase;, p47phox = subunidade citolósica da NADPH oxidase p47phox
O protocolo de exercício físico preconizado para melhora da capacidade cardiorrespiratória é aquele no qual o indivíduo faz exercício aeróbio moderado (corrida, natação, ciclismo são os mais comuns), com intensidade entre 50% a 75% do consumo máximo de oxigênio (VO
2max), com 3 a 5 sessões semanais e duração entre 30 e 60 minutos de atividade contínua [66,67]. Considerando que existe grande variabilidade individual em resposta à prescrição de treinamento fisico com relação ao volume de treinamento (envolvendo a intensidade, a frequência e a duração das sessões) é necessário avaliar as condições físicas e clínicas de cada indivíduo para que haja obtenção efetiva de efeitos benéficos à saúde.
Assim, a intensidade do exercício físico pode ser medida pela frequência cardíaca máxima (FCmax) utilizando-se a fórmula: FCmax = 220 - idade. A partir dessa fórmula calcula-se os porcentuais da FCmax que se deseja, e então se determina as diferentes intensidades, considerando exercício moderado entre 55% a 80% da FCmax. Pode-se ainda determinar a intensidade do treinamento físico a partir da frequência cardíaca de reserva (FCreserva), na qual se considera a frequência cardíaca de repouso (FCrepouso) do sujeito e utiliza-se a seguinte equação [68]: FCreserva = FC repouso + I. (FCmax - FCrepouso); onde I é considerada a intensidade do exercício a ser realizado em decimal, moderado entre 50% a 75% da FCreserva. A escala de Borg de percepção subjetiva de esforço também deve ser utilizada no acompanhamento do treinamento, considerando como referência um nível moderado de 12 a 14 na escala [69,70].
Especificamente, o programa de exercício físico na preparação de pacientes para cirurgias cardiotorácicas deve envolver exercício aeróbio (bicicleta ergométrica ou caminhada em esteira) de 3 a 5 vezes por semana, de 10 a 30 minutos, que deve ser feito com a mesma intensidade (contínuo), entre 40% a 60% da FCreserva, durante um período de pelo menos 8 semanas, previamente ao processo cirúrgico. Muitos pacientes apresentam limitações pela diminuição das funções respiratórias, os exercícios de moderada intensidade produzem os melhores benefícios e devem ser encorajados, no entanto, os exercícios de baixa intensidade também apresentam benefícios para aqueles pacientes que não podem alcançar esta intensidade. Intervalos durante o treinamento podem ser úteis, e eficazes em promover a tolerânica na prática de exercícios de baixa a moderada intensidade. A prescrição do exercício deve envolver criteriosa avaliação clínica, sendo que as sessões de treinamento, bem como a prescrição do exercício fisico, devem ser feitas por profissional de educação física, e estar sob sua direta supervisão. Assim, o preparo pré-cirúrgico dos pacientes deve envolver equipe multidisciplinar da área de saúde. Além disso, a inclusão do treinamento físico como preparo pré-cirúrgico poderá propiciar redução das complicações advindas do processo de cirurgia cardiotorácica, redução do período de internação hospitalar e, consequemente, melhorar a recuperação do paciente, acarretando ainda menor gastos para o sistema de saúde.
Os benefícios da prática regular de exercício físico aeróbio também têm sido demonstrados na reabilitação pulmonar, com aumento da função pulmonar e qualidade de vida em indivíduos submetidos ao transplante pulmonar. Esses estudos envolveram exercício físico aeróbio (bicicleta ergométrica e caminhada em esteira), 3 a 5 vezes por semana, por 30 a 60 minutos, intensidade 30 a 60% FCreserva e percepção subjetiva de esforço 13 a 14. O tempo mínimo após o transplante para iniciar o protocolo de treinamento nesses estudos variou entre 1 a 6 meses [71-73]. Assim, o treinamento fisico deve ser feito também após o processo cirúrgico para que o paciente possa ter melhor qualidade de vida e obter independência em suas atividades diárias e profissionais.
CONCLUSÃO
O processo de IR pulmonar está associado à infiltração de neutrófilos nos pulmões, edema pulmonar, intensa resposta inflamatória e alterações vasculares locais e sistêmicas, com alta taxa de morbidade e mortalidade. O exercício físico aeróbio de moderada intensidade tem sido empregado como importante ferramenta na prevenção e/ou tratamento de diversas doenças cardiovasculares e endócrino-metabólicas. Estudos em modelos animais saudáveis demonstram que a prática regular de exercício físico prévio melhora e/ou previne as lesões locais e sistêmicas provocadas pelo processo de IR pulmonar. Portanto, a prática regular de exercício físico supervisionada seria de grande relevância tanto na redução de comorbidades como na prevenção das complicações pós-cirúrgicas associadas ao processo de IR pulmonar. Portanto, a inclusão do treinamento fisico aeróbio de baixa a moderada intensidade como preparo pré-cirúrgico e como auxiliar no processo de recuperação pós-cirúrgico é de grande relevância na área de cirurgia cardiovascular, pois propiciará redução das complicações advindas do processo cirúrgico, redução do período de internação hospitalar e, consequentemente, melhora na recuperação do paciente, acarretando ainda menor gastos para o sistema de saúde.
AGRADECIMENTOS
Agradecemos à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) pelo apoio financeiro.
REFERÊNCIAS
1. Delbin MA, Moraes C, Camargo E, Mussi RK, Antunes E, de Nucci G, et al. Influence of physical preconditioning on the responsiveness of rat pulmonary artery after pulmonary ischemia/reperfusion. Comp Biochem Physiol A Mol Integr Physiol. 2007;147(3):793-8. [
MedLine]
2. Mussi RK, Camargo EA, Ferreira T, De Moraes C, Delbin MA, Toro IF, et al. Exercise training reduces pulmonary ischemia-reperfusion-induced inflammatory response. Eur Respir J. 2008;31(3):645-9. [
MedLine]
3. Delbin MA, Davel AP, Bau FR, Priviero FBM, Rossoni LV, Antunes E, et al. Reduction in vascular oxidative stress and improvement of NO/cGMP pathway in trained rats after lung ischemia/reperfusion. In: Inter-American Society of Hypertension 18th Scientific Sessions. 17º Congresso da Sociedade Brasileira de Hipertensão, 2009;Belo Horizonte. Hipertensão. 2009;12(supl 1):8.
4. Hosenpud JD, Bennett LE, Keck BM, Boucek MM, Novick RJ. The Registry of the International Society for Heart and Lung Transplantation: seventeenth official report-2000. J Heart Lung Transplant. 2000;19(10):909-31. [
MedLine]
5. Ng CS, Wan S, Yim AP, Arifi AA. Pulmonary dysfunction after cardiac surgery. Chest. 2002;121(4):1269-77. [
MedLine]
6. Zanesco A. Células endoteliais. In: Células: uma abordagem multidisciplinar. 1ª ed. São Paulo:Manole;2005. p.184-91.
7. Ignarro LJ. Nitric oxide: a unique endogenous signaling molecule in vascular biology. Biosci Rep. 1999;19(2):51-71. [
MedLine]
8. Barst RJ, McGoon M, Torbicki A, Sitbon O, Krowka MJ, Olschewski H, et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol. 2004;43(12 Suppl S):40S-7S.
9. Yildiz P. Molecular mechanisms of pulmonary hypertension. Clin Chim Acta. 2009;403(1-2):9-16. [
MedLine]
10. Ricachinevsky CP, Amantéa SL. Treatment of pulmonary arterial hypertension. J Pediatr (Rio J). 2006;82(5 Suppl):S153-65. [
MedLine]
11. Andrejaitiene J, Sirvinskas E, Bazeliene R. Prevention of pulmonary alterations after cardiopulmonary bypass. Medicina (Kaunas). 2004;40(6):517-21. [
MedLine]
12. Zapol WM, Snider MT. Pulmonary hypertension in severe acute respiratory failure. N Engl J Med. 1977;296(9):476-80. [
MedLine]
13. Cremona G, Dinh Xuan AT, Higenbottam TW. Endotheliumderived relaxing factor and the pulmonary circulation. Lung. 1991;169(4):185-202. [
MedLine]
14. Antoniazzi P, Pereira Jr GA, Marson F, Abeid M, Baldisserotto S, Basile-Filho A. Síndrome da angústia respiratória aguda (SARA). Medicina. 1998:31:493-506.
15. Esme H, Fidan H, Koken T, Solak O. Effect of lung ischemiareperfusion on oxidative stress parameters of remote tissues. Eur J Cardiothorac Surg. 2006;29(3):294-8. [
MedLine]
16. Scannell G. Leukocyte responses to hypoxic/ischemic conditions. New Horiz. 1996;4(2):179-83. [
MedLine]
17. Reilly PM, Schiller HJ, Bulkley GB. Pharmacologic approach to tissue injury mediated by free radicals and other reactive oxygen metabolites. Am J Surg. 1991;161(4):488-503. [
MedLine]
18. de Perrot M, Liu M, Waddell TK, Keshavjee S. Ischemia-reperfusion-induced lung injury. Am J Respir Crit Care Med. 2003:167(4):490-511. [
MedLine]
19. Horiguchi T, Harada Y. The effect of protease inhibitor on reperfusion injury after unilateral pulmonary ischemia. Transplantation. 1993;55(2):254-8. [
MedLine]
20. Carden DL, Granger DN. Pathophysiology of ischaemiareperfusion injury. J Pathol. 2000;190(3):255-66. [
MedLine]
21. Seal JB, Gewertz BL. Vascular dysfunction in ischemia/reperfusion injury. Ann Vasc Surg. 2005;19(4):572-84. [
MedLine]
22. Overand PT, Bishop MJ, Eisenstein BL, Chi EY, Su M, Cheney FW. Lack of alveolar O2 during lung reperfusion does not decrease edema formation. J Appl Physiol. 1989;67(2):528-33. [
MedLine]
23. Chan RK, Ibrahim SI, Verna N, Carroll M, Moore FD Jr, Hechtman HB. Ischaemia-reperfusion is an event triggered by immune complexes and complement. Br J Surg. 2003;90(12):1470-8. [
MedLine]
24. Horgan MJ, Wright SD, Malik AB. Antibody against leukocyte integrin (CD18) prevents reperfusion-induced lung vascular injury. Am J Physiol. 1990;259(4Pt[part]1[/part]):L315-9. [
MedLine]
25. Albelda SM, Buck CA. Integrins and other cell adhesion molecules. FASEB J. 1990;4(11):2868-80. [
MedLine]
26. Novick RJ, Gehman KE, Ali IS, Lee J. Lung preservation: the importance of endothelial and alveolar type II cell integrity. Ann Thorac Surg. 1996;62(1):302-14. [
MedLine]
27. Eckenhoff RG, Dodia C, Tan Z, Fisher AB. Oxygen-dependent reperfusion injury in the isolated rat lung. J Appl Physiol. 1992;72(4):1454-60. [
MedLine]
28. Date H, Matsumura A, Manchester JK, Obo H, Lima O, Cooper JM, et al. Evaluation of lung metabolism during successful twenty-four-hour canine lung preservation. J Thorac Cardiovasc Surg. 1993;105(3):480-91. [
MedLine]
29. Hamblin AS. Cytokines and cytokine receptors. 2nd ed. New York:Oxford University Press;1993.
30. Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome. J Pathol. 2004;202(2):145-56. [
MedLine]
31. Ertel W, Morrison MH, Wang P, Ba ZF, Ayala A, Chaudry IH. The complex pattern of cytokines in sepsis. Association between prostaglandins, cachectin, and interleukins. Ann Surg. 1991;214(2):141-8. [
MedLine]
32. Krishnadasan B, Naidu BV, Byrne K, Fraga C, Verrier ED, Mulligan MS. The role of proinflammatory cytokines in lung ischemia-reperfusion injury. J Thorac Cardiovas Surg. 2003;125(2):261-72.
33. Hocking DC, Phillips PG, Ferro TJ, Johnson A. Mechanisms of pulmonary edema induced by tumor necrosis factor-alpha. Circ Res. 1990;67(1):68-77. [
MedLine]
34. Koga S, Morris S, Ogawa S, Liao H, Bilezikian JP, Chen G, et al. TNF modulates endothelial properties by decreasing cAMP. Am J Physiol. 1995;268(5 Pt [part]1[/part]):C1104-13. [
MedLine]
35. Putensen C, Wrigge H. Ventilator-associated systemic inflammation in acute lung injury. Intensive Care Med. 2000;26(10):1411-3. [
MedLine]
36. Vane JR, Bakhle YS, Botting RM. Cyclooxigenases 1 and 2. Annu Rev Pharmacol Toxicol. 1998;38:97-120. [
MedLine]
37. Hack CE, Aarden LA, Thijs LG. Role of cytokines in sepsis. Adv Immunol. 1997;66:101-95. [
MedLine]
38. Giannoudis PV, Smith RM, Banks RE, Windsor AC, Dickson RA, Guillou PJ. Stimulation of inflammatory markers after blunt trauma. Br J Surg. 1998;85(7):986-90. [
MedLine]
39. Rizzo M, SivaSai KS, Smith MA, Trulock EP, Lynch JP, Patterson GA, et al. Increased expression of inflammatory cytokines and adhesion molecules by alveolar macrophages of human lung allograft recipients with acute rejection: decline with resolution of rejection. J Heart Lung Transplant. 2000;19(9):858-65. [
MedLine]
40. Teng S, Kurata S, Katoh I, Georgieva GS, Nosaka T, Mitaka C, et al. Cytokine mRNA expression in unilateral ischemicreperfused rat lung with salt solution supplemented with lowendotoxin or standard bovine serum albumin. Am J Physiol Lung Cell Mol Physiol. 2004;286(1):L137-42. [
MedLine]
41. Frederiks WM, Kooji A, Bosch KS. Role of xanthine oxidase activity in tissue damage of rat liver after ischemia. Transplant Proc. 1995;27(5):2855-6. [
MedLine]
42. García-Valdecasas JC, Rull R, Grande L, Fuster J, Rimola A, Lacy AM, et al. Prostacyclin, thromboxane, and oxygen free radicals and postoperative liver function in human liver transplantation. Transplantation. 1995;60(7):662-7. [
MedLine]
43. Halliwell B, Gutteridge JM, Cross CE. Free radicals, antioxidants, and human disease: where are we now? J Lab Clin Med. 1992;119(6):598-620. [
MedLine]
44. Jurmann MJ, Dammenhayn L, Schaefers HJ, Haverich A. Pulmonary reperfusion injury: evidence for oxygen-derived free radical mediated damage and effects of different free radical scavengers. Eur J Cardiothorac Surg. 1990;4(12):665-70. [
MedLine]
45. Russell WJ, Jackson RM. Hydrogen peroxide release by mitochondria from normal and hypoxic lungs. Am J Med Sci. 1994;308(4):239-43. [
MedLine]
46. Lassègue B, Clempus RE. Vascular NAD(P)H oxidases: specific features, expression, and regulation. Am J Physiol Regul Integr Comp Physiol. 2003:285(2):R277-97. [
MedLine]
47. Fortuño A, San José G, Moreno MU, Díez J, Zalba G. Oxidative stress and vascular remodelling. Exp Physiol. 2005;90(4):457-62. [
MedLine]
48. Ray R, Shah AM. NADPH oxidase and endothelial cell function. Clin Sci (Lond). 2005:109(3):217-26. [
MedLine]
49. Bayraktutan U, Blayney L, Shah AM. Molecular characterization and localization of the NAD(P)H oxidase components gp91-phox and p22-phox in endothelial cells. Arterioscler Thromb Vasc Biol. 2000;20(8):1903-11. [
MedLine]
50. Shinozaki K, Kashiwagi A, Nishio Y, Okamura T, Yoshida Y, Masada M, et al. Abnormal biopterin metabolism is a major cause of impaired endothelium-dependent relaxation through nitric oxide/O2- imbalance in insulin-resistant rat aorta. Diabetes. 1999;48(12):2437-45. [
MedLine]
51. Beckman JS, Koppenol WH. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and ugly. Am J Physiol. 1996;271(5 Pt [part]1[/part]):C1424-37. [
MedLine]
52. Schneider CD, Oliveira AR. Radicais livres de oxigênio e exercício: mecanismos de formação e adaptação ao treinamento físico. Rev Bras Med Esporte. 2004;10(4):308-13.
53. Ferreira ALA, Matsubara LS. Radicais livres: conceitos, doenças relacionadas, sistema de defesa e estresse oxidativo. Rev Assoc Med Bras. 1997;43(1):61-8. [
MedLine]
54. McArdle W, Katch F, Katch V. Fisiologia do exercício; energia, nutrição e desempenho humano. 4ª ed. Rio de Janeiro:Guanabara Koogan;1998.
55. Hull SS Jr, Vanoli E, Adamson PB, Verrier RL, Foreman RD, Schwartz PJ. Exercise training confers anticipatory protection from sudden death during acute myocardial ischemia. Circulation. 1994;89(2):548-52. [
MedLine]
56. Brown DA, Jew KN, Sparagna GC, Musch TI, Moore RL. Exercise training preserves coronary flow and reduces infarct size after ischemia-reperfusion in rat heart. J Appl Physiol. 2003;95(6):2510-8. [
MedLine]
57. Ciolac EG, Guimarães GV. Exercício físico e síndrome metabólica. Rev Bras Med Esporte. 2004;10(6):319-24.
58. Claudino MA, Priviero FB, Teixeira CE, de Nucci G, Antunes E, Zanesco A. Improvement in relaxation response in corpus cavernosum from trained rats. Urology. 2004;63(5):1004-8. [
MedLine]
59. Woodman CR, Thompson MA, Turk JR, Laughlin MH. Endurance exercise training improves endothelium-dependent relaxation in brachial arteries from hypercholesterolemic male pigs. J Appl Physiol. 2005;99(4):1412-21. [
MedLine]
60. Zanesco A, Antunes E. Effects of exercise training on the cardiovascular system: pharmacological approaches. Pharmacol Ther. 2007;114(3):307-17. [
MedLine]
61. Woodman CR, Muller JM, Laughlin MH, Price EM. Induction of nitric oxide synthase mRNA in coronary resistance arteries isolated from exercise-trained pigs. Am J Physiol. 1997;273(6 pt [part]2[/part]):H2575-9. [
MedLine]
62. Kingwell BA. Nitric oxide-mediated metabolic regulation during exercise: effects of training in health and cardiovascular disease. FASEB J. 2000;14(12):1685-96. [
MedLine]
63. Rush JW, Turk JR, Laughlin MH. Exercise training regulates SOD-1 and oxidative stress in porcine aortic endothelium. Am J Physiol Heart Circ Physiol. 2003;284(4):H1378-87. [
MedLine]
64. Munro PE, Holland AE, Bailey M, Button BM, Snell GI. Pulmonary rehabilitation following lung transplantation. Transplant Proc. 2009;41(1):292-5. [
MedLine]
65. Febbraio MA, Pedersen BK. Muscle-derived interleukin-6: mechanisms for activation and possible biological roles. FASEB J. 2002;16(11):1335-47. [
MedLine]
66. Howley ET, Franks BD. Health fitness instructor's handbook. 2nd ed.Champaign:Human Kinetics;1992.
67. American College of Sports Medicine. Manual do ACSM para teste de esforço e prescrição de exercício. Tradução: Paula Chermont P. Estima. 5ª ed. Rio de Janeiro:Revinter;2000.
68. Karvonen MJ, Kentala E, Mustala O. The effects of training on heart rate: a longitudinal study. Ann Med Exp Biol Fenn. 1957;35(3):307-15. [
MedLine]
69. Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 1982;14(5):377-81. [
MedLine]
70. American College of Sports Medicine Position Stand. The recommended quantity and quality of exercise for developing and maintaining cardiorespiratory and muscular fitness, and flexibility in healthy adults. Med Sci Sports Exerc. 1998;30(6):975-91. [
MedLine]
71. Ambrosino N, Bruschi C, Callegari G, Baiocchi S, Felicetti G, Fracchia C, et al. Time course of exercise capacity, skeletal and respiratory muscle performance after heart-lung transplantation. Eur Respir J. 1996;9(7):1508-14. [
MedLine]
72. Stiebellehner L, Quittan M, End A, Wieselthaler G, Klepetko W, Haber P, et al. Aerobic endurance training program improves exercise performance in lung transplant recipients. Chest. 1998;113(4):906-12. [
MedLine]
73. Suzuki K, Nakaji S, Yamada M, Totsuka M, Sato K, Sugawara . K. Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exerc Immunol Rev. 2002;8:6-48. [
MedLine]


 All scientific articles published at bjcvs.org are licensed under a Creative Commons license
All scientific articles published at bjcvs.org are licensed under a Creative Commons license