INTRODUÇÃO
O acesso cirúrgico em doenças cardíacas com técnicas minimamente invasivas evoluiu nos últimos anos, mas as dificuldades de exposição e visibilização das estruturas cardíacas limitaram sua ascensão. Com o advento da videocirurgia em cirurgia geral e sua aplicação em cirurgia cardíaca, os procedimentos minimamente invasivos têm se tornado cada vez mais freqüentes. A robótica com instrumentos articulados e motorizados aprimoram essa nova técnica.
Iniciamos nossos trabalhos com videocirurgia cardíaca em 2006, por meio da experiência adquirida com cirurgia torácica e geral. Sempre que houve possibilidade de se realizar uma cirurgia cardíaca por acesso minimamente invasivo, esta foi a abordagem inicialmente utilizada. A conversão para cirurgia aberta foi aventada em caso de necessidade.
MÉTODOS
Os instrumentais utilizados envolveram um toracoscópio com diâmetro de 5 ou 10 mm, conforme a necessidade de campo visual, e angulação de lente de 30°, também instrumentais (ESTECH Inc., Califórnia-USA), idealizados especificamente para cirurgia cardíaca, como afastadores de átrio, tesouras, empurradores de nós, porta-agulha e contra porta-agulha). Outros instrumentos, como pinças, clampes, eletrocautério e grampeadores, além de câmara de vídeo e fonte de luz, foram os mesmos utilizados nas laparoscopias convencionais (Figura 1). Utilizamos insuflador de CO² e manômetro com pressão negativa nos casos de abertura da cavidade cardíaca. Os Kits de canulação femoral (DLP
® of Medtronic Inc., Minneapolis-USA) arterial e venosa foram utilizados na CEC periférica.

Fig. 1 - Visão panorâmica da minitoracotomia lateral direita para acesso a valva mitra, com os instrumentais de videoscopia
Os casos apresentados foram divididos em dois grupos, de acordo com o acesso e a necessidade de cardiotomia:
Grupo I
Toracoscopia lateral esquerda, sem cardiotomia, através de três portas de acesso de 10 mm para instrumentação, foi utilizada nos seguintes casos:
(1) Ligadura de fistula coronário-pulmonar sintomática, sem toracotomia.
- Paciente do sexo feminino, 45 anos, com diagnóstico de fistula coronário-pulmonar após meses de dor torácica e dispnéia (Figura 2).

Fig.2 - Aspecto videoscópico da ligadura da fístula coronário-pulmonar
(2) Implante de eletrodo epicárdico em ventrículo esquerdo para ressincronização ventricular, sem toracotomia.
- Paciente do sexo feminino, 53 anos, portadora de miocardiopatia dilatada classe funcional III (NYHA) com bloqueio completo do ramo esquerdo (Figura 3).

Fig. 3 - Visão endoscópica do eletrodo implantado em parede lateral de ventrículo esquerdo
(3)* Retirada de lipoma gigante de pericárdio com pedículo em átrio esquerdo.
- Paciente do sexo masculino, 32 anos, com dor torácica e extrassistolia freqüente e diagnóstico de lipoma gigante intrapericárdico aderido ao átrio esquerdo, por tomografia e ecocardiografia. Exame anatomopatológico revelou lipoma benigno com 900 gramas de peso.
(4)* Ressecção de hemangio-lipoma de mediastino.
- Paciente do sexo masculino, 55 anos, com achado radiológico de alargamento de mediastino e tomográfico de massa tumoral, diagnosticado ao anatomopatológico como hemangio-lipoma.
*Observação: Nos dois casos de lipoma, minitoracotomia foi utilizada para instrumentação e retirada dos grandes tumores.
Grupo II
Toracoscopia lateral direita com cardiotomia
Os casos do grupo II envolveram cardiotomia e, desse modo foram submetidos a circulação extracorpórea através de canulação arterial e venosa femorais. Kits de canulação de baixo perfil (DLP
® Medtronic Inc.), idealizados para circulação extracorpórea periférica, foram utilizados em ambos os casos. A introdução da cânula venosa até o átrio direito foi feita por visão direta ou videoscópica, não sendo necessária a utilização de ecocardiograma transesofágico (ETE). A parada cardíaca foi realizada com fibrilação ventricular hipotérmica, não sendo utilizado pinçamento transtorácico ou endoclamp.
(5) Comissurotomia em estenose mitral pós-plastia com anel de Carpentier 12 anos antes. Foi realizada circulação extracorpórea femoral com drenagem venosa com cânula femoral única (24 Fr) longa conduzida até átrio direito, por visão endoscópica e cânula arterial (17 Fr) em artéria femoral direita. Através de atriotomia esquerda sem dissecção pericárdica abaixo do nervo frênico e após exposição do átrio esquerdo sob videoscopia foi realizada a comissurotomia anterior e posterior. O procedimento ocorreu de forma totalmente endoscópica, sem incisões maiores do que as utilizadas para os trocateres e instrumentais, três portas de acesso foram utilizadas para instrumentação.
- Paciente do sexo feminino, 24 anos, com quadro de insuficiência cardíaca classe funcional III (NYHA) com história de estenose mitral reumática e plastia com anel de Carpentier aos 12 anos de idade, tendo como diagnóstico ecocardiográfico: reestenose mitral importante pós-plastia (Figura 4).
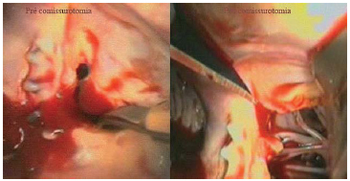
Fig. 4 - Aspecto videoscópico da valva mitral, pré e pós comissurotomia
(6) Plastia mitral e cirurgia de MAZE modificada foi realizada através de uma minitoracotomia ântero-lateral direita de 6 cm e acesso de 10 mm para toracoscópio. Circulação extracorpórea femoral com drenagem venosa com cânula femoral única (24 Fr) longa conduzida até átrio direito, por visão direta, e cânula arterial (17 Fr) em artéria femoral direita. Após drenagem das cavidades e fibrilação ventricular hipotermica (
+ 26º), foi realizada atriotomia esquerda e exposição do interior do átrio esquerdo sob videoscopia. Realizada plastia da valva mitral com anel de Gregori, ligadura da aurícula esquerda e ablação das veias pulmonares com cateter de radiofreqüência.
- Paciente, do sexo feminino, 59 anos, com miocardiopatia dilatada classe funcional III (NYHA), fibrilação atrial de alta resposta e insuficiência mitral grave.
RESULTADOS
Nenhum óbito ocorreu nesta série, o tubo traqueal foi retirado em todos os casos na sala cirúrgica a exceção do caso 6. Minitoracotomia auxiliou nos casos 3, 4 e 6. O caso 5 foi realizado de forma totalmente endoscópica, ou seja, sem toracotomia, a visão da cavidade torácica e atrial esquerda foi realizada totalmente de forma indireta, por videoscopia. A parada cardíaca, realizada pela fibrilação ventricular hipotérmica, não foi associada a complicações, dispensando o uso de pinçamento transtorácico ou endoclampeio aórtico. Foram utilizados kits de cânulas venosa e arterial para acesso periférico da circulação extracorpórea. Através de dissecção de artéria e veia femoral e introdução das cânulas pela técnica de Seldinger, o bypass cardiopulmonar foi instituído com sucesso.
O resultado cirúrgico nos pacientes foi altamente satisfatório, sendo que todos receberam alta hospitalar com média de internação de 5,4 dias
+ 6 dias após a intervenção e são acompanhados em ambulatório do serviço. Todos os pacientes optaram pelo procedimento minimamente invasivo e assinaram documento formal. A dor, exprimida pela quantidade de analgésicos utilizados, foi reduzida. Quando comparado à esternotomia mediana, o efeito estético foi referido como excelente pelos pacientes.
DISCUSSÃO
Na década de noventa do século passado, a cirurgia cardíaca minimamente invasiva (CMMI) trazia promessas de grandes resultados em relação à dor pós-operatória, efeito estético das pequenas incisões e redução do sangramento cirúrgico. Entretanto, devido aos resultados contraditórios, muitos relatos discutiam os procedimentos minimamente invasivos, quando comparados aos convencionais em relação a complicações e sobrevida. Vários estudos demonstraram maior índice de complicações nos procedimentos ditos pouco invasivos [1-3].
Em contrapartida, uma experiência de 1998 em 120 pacientes, comparando a técnica convencional com as mínimas incisões na cirurgia da valva aórtica, demonstrou semelhantes resultados na sobrevida, mas diferença expressiva quanto à dor pós-operatória, necessidade de hemo-transfusão, mínima analgesia e baixa incidência de arritmias nos casos minimamente invasivos [4]. Mulinari et al., em 1997, no Brasil, utilizaram a miniesternotomia em cirurgias valvares, obtendo resultados também promissores [5].
Com o advento da videocirurgia, da implementação das técnicas para acessos vasculares, das cânulas para circulação extracorpórea e do endoclampeio aórtico (port-access technology), os procedimentos minimamente invasivos em cirurgia cardíaca tomaram um novo rumo, com resultados cada vez mais promissores e relatados com maior freqüência [6-10].
Mesmo com essa evolução alguns estudos ainda discutem o procedimento. Numa série de 51 pacientes submetidos a reparo de valva mitral com port-access, foi relatada 9,8% de mortalidade hospitalar e 3,9% de conversão para cirurgia aberta por complicações do endoclampeio aórtico [9]. Em contrapartida, outro estudo avaliou 106 pacientes operados por minitoracotomia e port access, demonstrando resultados promissores quanto aos seguintes parâmetros: permanência em UTI (média de 31 horas), ausência de morte pós-operatória ou infecção de ferida cirúrgica e média de 5,6 dias de internação hospitalar [6].
Desde a última década são apresentados estudos multicêntricos para demonstrar a eficácia desse novo método. Galloway et al. [11], em 1999, reuniram dados de 121 centros, e incluíram 1.063 pacientes operados pelas técnicas minimamente invasivas, apresentando resultados similares aos da cirurgia convencional, com a vantagem da menor agressão, dor e uso de hemoderivados, além da alta hospitalar e retorno as atividades habituais muito mais precoces.
Mishra et al. [12] reuniram 776 pacientes, operados entre 1997 e 2004, com CCMI na valva mitral e defeitos do septo atrial. A mortalidade foi de 0,46% no grupo valvar; não houve mortalidade no grupo congênito. Ao final do relato, definem a cirurgia minimamente invasiva como método "standard" de tratamento das lesões mitrais isoladas e defeitos do septo atrial. A rápida recuperação, vantagem cosmética e maior satisfação do paciente são os fatores que diferenciam o método em relação à esternotomia mediana.
Greco et al. [13] consideraram-se convencidos da superioridade do procedimento minimamente invasivo no tratamento da cirurgia da valva mitral e defeitos congênitos atriais, no relato de sua experiência com 129 pacientes.
Além das experiências já relatadas, muitos centros utilizando a sofisticação tecnológica da robótica demonstraram suas experiências e, apesar do alto investimento, coroaram os métodos minimamente invasivos pela baixa mortalidade, mínima permanência em UTI e alta hospitalar muito precoce.
Tatooles et al. [14], utilizando a cirurgia assistida pela robótica em 25 pacientes com doença mitral, enfatizaram, além dos excelentes resultados peri-operatórios, um período de internação muito reduzido, com média de 2,7 dias de estadia hospitalar. Entre a primeira e segunda fase da experiência, passou de 4,2 dias para 1,67 dias até a alta hospitalar. O uso do robô "da Vinci" permitiu excelente manipulação cirúrgica da valva mitral com sucesso no reparo primário em todos os casos.
Reichenspurner et al. [15,16], utilizando um vídeo com visão tridimensional (VISTA system) e assistência robótica com comando de voz (AESOP 3000), relataram a experiência com 50 procedimentos na valva mitral por minitoracotomia, não observaram mortalidade hospitalar e confirmaram as vantagens das mínimas incisões já relatadas em outros trabalhos da atualidade.
O Brasil incluiu-se neste rol com as experiências de Jatene et al. [17], que em 1997, relataram o uso da videotoracoscopia para dissecção de artéria torácica interna esquerda e seu implante coronário através de minitoracotomia. Setenta e três pacientes foram operados, com baixo índice de complicações e alta hospitalar precoce. Souto et al. [18], em 2000, demonstraram a técnica de fechamento do canal arterial através de videotoracoscopia. Nos 40 pacientes, destacaram a simplicidade e singularidade do novo método de abordagem [18]. Salerno et al. [19], também em 2000, relataram experiência semelhante em 15 crianças com persistência do canal arterial, em seus resultados enfatizaram excelente efeito estético e baixo índice de complicações. Mesmo com estas experiências são poucos os trabalhos nacionais com as técnicas videoassistidas. Nenhum caso havia sido relatado, a nível nacional, quando iniciamos nossos trabalhos com CMMI em valva mitral.
Hoje, no mundo é cada vez maior a utilização da videocirurgia cardíaca para tratamento das doenças valvares, coronárias e congênitas, ficando na habilidade dos cirurgiões a maior expansão e definitiva consagração destes procedimentos [11,12,20,21].
O relato de nossa experiência visa à demonstração da utilização da videocirurgia em uma ampla variedade de doenças cardíacas, os primeiros casos em situações de atuação na periferia do coração, seguidos pelos procedimentos que envolveram o apoio da circulação extracorpórea periférica na cirurgia da valva mitral.
Os casos de lipoma cardíaco e fistula coronária foram incluídos no presente trabalho com o intuito de demonstrar a possibilidade de se utilizar a videocirurgia em situações eventuais, estimulando os cirurgiões na busca de acessos alternativos às mínimas incisões. Uma pesquisa feita na literatura atual não relatou experiências nestes casos.
O implante de eletrodo epicárdico, via toracoscopia esquerda, para ressincronização ventricular, está bem documentado na literatura [22]. Sua implementação foi estimulada devido ao grau variável de insucesso no implante do eletrodo de ventrículo esquerdo pelo seio coronário. A nova técnica é simples e realizada de forma totalmente endoscópica, os acessos não se utilizam de toracotomia, como no método convencional, mas de três pequenas incisões para introdução do instrumental e fixação do eletrodo epicárdico ativo.
O ponto alto de nossa experiência foi mimetizar os trabalhos internacionais com valvopatia mitral [12,13,20]. Através da circulação extracorpórea instalada via vasos femorais e parada cardíaca em fibrilação ventricular hipotérmica, foi possível a realização de dois casos de plastia mitral. O primeiro em uma reoperação sobre a valva mitral, permitindo recomissurotomia com procedimento totalmente endoscópico (Figura 4). Relato semelhante foi apresentado em cirurgia para correção de defeito do septo atrial com procedimentos mínimos também totalmente endoscópicos [23,24].
Casselman et al. [25] relataram o uso da cirurgia minimamente invasiva em reoperação de valva mitral com parada cardíaca em fibrilação ventricular, e consideraram a técnica como primeira opção em casos de reoperação mitral isolada. O segundo caso foi em uma paciente com cardiopatia dilatada e fibrilação atrial, no qual foi realizada com sucesso a plastia da valva mitral com anel de Gregori, ligadura da aurícula esquerda e ablação das veias pulmonares pela técnica de "Maze modificado.
As pequenas incisões são atraentes tanto para a equipe médica quanto para o paciente, a menor incidência de infecção e deiscência esternal, menor incidência de dor pós-operatória e alta hospitalar precoce estão bem documentadas em muitos trabalhos atuais [20,21].
A discussão quanto ao alto custo do procedimento é momentânea, pois com a maior experiência e os melhores resultados, o custo dos instrumentais tem tendência de diminuir gradativamente, desde que mais casos sejam tratados pela técnica videoassistida.
CONCLUSÃO
Nossa experiência inicial neste campo demonstra a eficácia e exeqüibilidade de introdução deste tipo de técnica em nosso meio. Os resultados alcançados nesta série estimulam os trabalhos com a cirurgia cardíaca videoassistida. O melhor resultado estético e conforto pós-operatório para o paciente, permitindo seu retorno precoce as atividades habituais, mantêm nosso empenho pela continuidade deste procedimento, acessível e promissor.
REFERÊNCIAS
1. Westaby S. Organ dysfunction after cardiopulmonary bypass: a systemic inflammatory reaction initiated by the extracorporeal circuit. Intensive Care Med. 1987;13(2):89-95. [
MedLine]
2. Edmunds LH Jr. Inflammatory response to cardiopulmonary bypass. Ann Thorac Surg. 1998;66(5 Suppl):S12-6.
3. Royston D. The inflammatory response and extracorporeal circulation. J Cardiothorac Vasc Anesth. 1997;11(3):341-54. [
MedLine]
4. Moat NE, Shore DF, Evans TW. Organ dysfunction and cardiopulmonary bypass: the role of complement and complement regulatory proteins. Eur J Cardiothorac Surg. 1993;7(11):563-73. [
MedLine]
5. Frering B, Philip I, Dehoux M, Rolland C, Langlois JM, Desmonts JM. Circulating cytokines in patients undergoing normothermic cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1994;108(4):636-41. [
MedLine]
6. Nashef SA, Roques F, Hammill BG, Peterson ED, Michel P, Grover FL, et al. Validation of European System for Cardiac Operative Risk Evaluation (EuroSCORE) in North American cardiac surgery. Eur J Cardiothorac Surg. 2002;22(1):101-5. [
MedLine]
7. Vincent JL, Mendonça A, Cantraine F, Moreno R, Takala J, Suter PM, et al. Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study. Working group on "sepsis-related problems" of the European Society of Intensive Care Medicine. Crit Care Med. 1998;26(11):1793-800. [
MedLine]
8. Ungerleider RM. Effects of cardiopulmonary bypass and use of modified ultrafiltration. Ann Thorac Surg. 1998;65( 6 Suppl):S35-8.
9. Tetta C, D'Intini V, Bellomo R, Bonello M, Bordoni V, Ricci Z, et al. Extracorporeal treatments in sepsis: are there new perspectives? Clin Nephrol. 2003;60(5):299-304. [
MedLine]
10. Biglioli P, Cannata A, Alamanni F, Naliato M, Porqueddu M, Zanobini M, et al. Biological effects of off-pump vs. on-pump coronary artery surgery: focus on inflammation, hemostasis and oxidative stress. Eur J Cardiothorac Surg. 2003;24(2):260-9. [
MedLine]
11. Wang MJ, Chiu IS, Hsu CM, Wang CM, Lin PL, Chang CI, et al. Efficacy of ultrafiltration in removing inflammatory mediators in pediatric cardiac operations. Ann Thorac Surg. 1996;61(2):651-6. [
MedLine]
12. Wan S, Yim AP, Arifi AA, Lee TW, Huynh CH, DeSmet JM, et al. Can cardioplegia management influence cytokine responses during clinical cardiopulmonary bypass? Ann Thorac Cardiovasc Surg. 1999;5(2):81-5. [
MedLine]
13. Brunet S, Leblanc M, Geadah D, Parent D, Courteau S, Cardinal J. Diffusive and convective solute clearances during continuous renal replacement therapy at various dialysate and ultrafiltration flow rates. Am J Kidney Dis. 1999;34(3):486-92. [
MedLine]
14. Venkataraman R, Subramanian S, Kellum JA. Clinical review: extracorporeal blood purification in severe sepsis. Crit Care. 2003;7(2):139-45. [
MedLine]
15. Dinarello CA. Proinflammatory and anti-inflammatory cytokines as mediators in the pathogenesis of septic shock. Chest. 1997;112(6 Suppl):321S-9S.
16. Janovich HB. The cytokine handbook. London:Academic Press;1991. p.5.
17. Butler J, Rocker GM, Westaby S. Inflammatory response to cardiopulmonary bypass. Ann Thorac Surg. 1993;55(2):552-9. [
MedLine]
18. Butler J, Chong GL, Baigrie RJ, Pillai R, Westaby S, Rocker GM. Cytokine responses to cardiopulmonary bypass with membrane and bubble oxygenation. Ann Thorac Surg. 1992;53(5):833-8. [
MedLine]
19. Ohzato H, Yoshizaki K, Nishimoto N, Ogata A, Tagoh H, Monden M, et al. Interleukin-6 as a new indicator of inflammatory status: detection of serum levels of interleukin-6 and C-reactive protein after surgery. Surgery. 1992;111(2):201-9. [
MedLine]
20. Royston D, Fleming JS, Desai JB, Westaby S, Taylor KM. Increased production of peroxidation products associated with cardiac operations: evidence for free radical generation. J Thorac Cardiovasc Surg. 1986;91(5):759-66. [
MedLine]
21. Finn A, Naik S, Klein N, Levinsky RJ, Strobel S, Elliott M. Interleukin-8 release and neutrophil degranulation after pediatric cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1993;105(2):234-41. [
MedLine]
22. George JF. Invited letter concerning: cytokines and mechanisms of capillary leakage after cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1993;106(3):566-7. [
MedLine]
23. Brasil LA, Gomes WJ, Salomão R, Buffolo E. Inflammatory response after myocardial revascularization with or without cardiopulmonary bypass. Ann Thorac Surg. 1998;66(1):56-9. [
MedLine]
24. Chenoweth DE, Cooper SW, Hugli TE, Stewart RW, Blackstone EH, Kirklin JW. Complement activation during cardiopulmonary bypass: evidence for generation of C3a and C5a anaphylatoxins. N Engl J Med. 1981;304(9):497-503. [
MedLine]
25. Hill GE, Alonso A, Thiele GM, Robbins RA. Glucocorticoids blunt neutrophil CD11b surface glycoprotein upregulation during cardiopulmonary bypass in humans. Anesth Analg. 1994;79(1):23-7. [
MedLine]
26. Inaba H, Kochi A, Yorozu S. Suppression by methylprednisolone of augmented plasma endotoxin-like activity and interleukin-6 during cardiopulmonary bypass. Br J Anaesth. 1994;72(3):348-50. [
MedLine]
27. Dietzman RH, Casteda AR, Lillehei CW, Ersera, Motsay GJ, Lillehei RC. Corticosteroids as effective vasodilators in the treatment of low output syndrome. Chest. 1970;57(5):440-53. [
MedLine]
28. Niazi Z, Flodin P, Joyce L, Smith J, Mauer H, Lillehei RC. Effects of glucocorticosteroids in patients undergoing coronary artery bypass surgery. Chest. 1979;76(3):262-8. [
MedLine]
29. Fey K, Follette D, Livesay J, Nelson R, Bugyi H, DeLand, et al. Effects of membrane stabilization on the safety of hypothermic arrest after aortic cross-clamping. Circulation. 1977;56(3 Suppl):II143-7. [
MedLine]
30. Fosse E, Mollnes TE, Ingvaldsen B. Complement activation during major operations with or without cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1987;93(6):860-6. [
MedLine]
31. Brasil LA, Gomes WJ, Salomão R, Fonseca JHP, Branco JNR, E Buffolo. Uso de corticóide como inibidor da resposta inflamatória sistêmica induzida pela circulação extracorpórea. Rev Bras Cir Cardiovasc. 1999;14(3):254-68.
32. Jansen NJ, van Oeveren W, van den Broek L, Oudemans-van Straaten HM, Stoutenbeek CP, Joen MC, et al. Inhibition by dexamethasone of the reperfusion phenomena in cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1991;102(4):515-25. [
MedLine]
33. Liakopoulos OJ, Teucher N, Mühlfeld C, Middel P, Heusch G, Schoendube FA, et al. Prevention of TNFalpha-associated myocardial dysfunction resulting from cardiopulmonary bypass and cardioplegic arrest by glucocorticoid treatment. Eur J Cardiothorac Surg. 2006;30(2):263-70. [
MedLine]
34. Liakopoulos OJ, Schmitto JD, Kazmaier S, Bräuer A, Quintel M, Schoendube FA, et al. Cardiopulmonary and systemic effects of methylprednisolone in patients undergoing cardiac surgery. Ann Thorac Surg. 2007;84(1):110-8.
35. De Vriese AS, Colardyn FA, Philippé JJ, Vanholder RC, De Sutter JH, Lameire NH. Cytokine removal during continuous hemofiltration in septic patients. J Am Soc Nephrol. 1999;10(4):846-53. [
MedLine]
1. Bridgewater B, Steyn RS, Ray S, Hooper T. Minimally invasive aortic valve replacement through a transverse sternotomy: a word of caution. Heart. 1998;79(6):605-7. [
MedLine]
2. Szwerc MF, Benckart DH, Wiechmann RJ, Savage EB, Szydlowski GW, Magovern GJ Jr, et al. Partial versus full sternotomy for aortic valve replacement. Ann Thorac Surg. 1999;68(6):2209-13.
3. Kort S, Applebaum RM, Gross EA, Baumann FG, Colvin SB, Galloway AC, et al. Minimally invasive aortic valve replacement: echocardiographic and clinical results. Ann Thorac Surg. 2001;142(3):476-81.
4. Mächler HE, Bergmann P, Anelli-Monti M, Dacar D, Rehak P, Knez I, et al. Minimally invasive versus conventional aortic valve operations: a prospective study in 120 patients. Ann Thorac Surg. 1999;67(4):1001-5. [
MedLine]
5. Mulinari LA, Tyszka AL, Costa FDA, Carvalho RG, Silva Junior AZ, Giublin R, et al. Miniesternotomia: um acesso seguro para a cirurgia cardíaca. Rev Bras Cir Cardiovasc. 1997;12(4):335-9.
6. Aklog L, Adams DH, Couper GS, Gobezie R, Sears S, Cohn LH. Techniques and results of direct-access minimally invasive mitral valve surgery: a paradigm for the future. J Thorac Cardiovasc Surg. 1998;116(5):705-15. [
MedLine]
7. Chitwood WR Jr, Wixon CL, Elbeery JR, Moran JF, Chapman WH, Lust RM. Video-assisted minimally invasive mitral valve surgery. J Thorac Cardiovasc Surg. 1997;114(5):773-80.
8. Grossi EA, LaPietra A, Ribakove GH, Delianides J, Esposito R, Culliford AT, et al. Minimally invasive versus sternotomy approaches for mitral reconstruction: comparison of intermediate-term results. J Thorac Cardiovasc Surg. 2001;121(4):708-13. [
MedLine]
9. Morh FW, Falk V, Diegeler A, Walther T, van Son JA, Autschbach R. Minimally invasive port-access mitral valve surgery. J Thorac Cardiovasc Surg. 1998;115(3):567-74.
10. Stevens JH, Burdon TA, Peters WS, Siegel LC, Pompili MF, Vierra MA, et al. Port-access coronary artery bypass grafting: a proposed surgical method. J Thorac Cardiovasc Surg. 1996;111(3):567-73. [
MedLine]
11. Galloway AC, Shemin RJ, Glower DD, Boyer JH Jr, Groh MA, Kuntz RE, et al. First report of the Port Access International Registry. Ann Thorac Surg. 1999;67(1):51-6.
12. Mishra YK, Khanna SN, Wasir H, Sharma KK, Mehta Y, Trehan N. Port-access approach for cardiac surgical procedures: our experience in 776 patients. Indian Heart J. 2005;57(6):688-93. [
MedLine]
13. Greco E, Barriuso C, Castro MA, Fita G, Pomar JL. Port-Access cardiac surgery: from a learning process to the standard. Heart Surg Forum. 2002;5(2):145-9. [
MedLine]
14. Tatooles AJ, Pappas PS, Gordon PJ, Slaughter MS. Minimally invasive mitral valve repair using the da Vinci robotic system. Ann Thorac Surg. 2004;77(6):1978-82.
15. Reichenspurner H, Boehm D, Reichart B. Minimally invasive mitral valve surgery using three-dimensional video and robotic assistance. Semin Thorac Cardiovasc Surg. 1999;11(3):235-43. [
MedLine]
16. Reichenspurner H, Boehm DH, Gulbins H, Schulze C, Wildhirt S, Welz A, et al. Three-dimensional video and robot-assisted port-access mitral valve operation. Ann Thorac Surg. 2000;69(4):1176-81.
17. Jatene FB, Pego-Fernandes PM, Assad RS, Dallan LA, Hueb W, Arbulu HEVD, et al. Cirurgia de revascularização do miocárdio minimamente invasiva: resultados com o uso da videotoracoscopia e do estabilizador de sutura. Rev Bras Cir Cardiovasc. 1997;12(3):233-8.
18. Souto GLL, Tinoco RC, Tinoco ACA, Caetano CS, Souza JB, Paula AG, et al. Ligadura videotoracoscópica da persistência do canal arterial. Rev Bras Cir Cardiovasc. 2000;15(2):154-9.
19. Salerno PR, Jatene MB, Santos MA, Ponce F, Bosísio IBJ, Fontes VF, et al. Fechamento de canal arterial por minitoracotomia: técnica e resultados. Rev Bras Cir Cardiovasc. 2000;15(3):234-7.
20. Grossi EA, Galloway AC, LaPietra A, Ribakove GH, Ursomanno P, Delianides J, et al. Minimally invasive mitral valve surgery: a 6-year experience with 714 patients. Ann Thorac Surg. 2002;74(3):660-3.
21. Woo YJ, Nacke EA. Robotic minimally invasive mitral valve reconstruction yields less blood product transfusion and shorter length of stay. Surgery. 2006;140(2):263-7. [
MedLine]
22. Navia JL, Atik FA, Grimm RA, Garcia M, Vega PR, Myhre U, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79(5):1536-44.
23. Argenziano M, Oz MC, DeRose JJ Jr, Ashton RC Jr, Beck J, Wang F, et al. Totally endoscopic atrial septal defect repair with robotic assistance. Heart Surg Forum. 2002;5(3):294-300. [
MedLine]
24. Torracca L, Ismeno G, Quarti A, Alfieri O. Totally endoscopic atrial septal defect closure with a robotic system: experience with seven cases. Heart Surg Forum. 2002;5(2):125-7. [
MedLine]
25. Casselman FP, La Meir M, Jeanmart H, Mazzarro E, Coddens J, Van Praet F, et al. Endoscopic mitral and tricuspid valve surgery after previous cardiac surgery. Circulation. 2007;116(11 Suppl):I270-5. [
MedLine]




 All scientific articles published at bjcvs.org are licensed under a Creative Commons license
All scientific articles published at bjcvs.org are licensed under a Creative Commons license