INTRODUÇÃO
Na última década, um número considerável de estudos comprovou que o sangue de cordão umbilical humano (SCU) possui células-tronco hematopoéticas (CTH) e um pool de células-tronco mesenquimais (CTM). As CTM possuem potencial de proliferação e diferenciação em múltiplas linhagens, semelhantemente ao observado nas células da medula óssea.
Essas características criaram expectativas de uso em terapias celulares para regeneração de tecidos e órgãos acometidos por doenças tidas como incuráveis, como as neurológicas, cardíacas, renais, etc. No entanto, como essas células correspondem a apenas uma pequena parcela das células mononucleares presentes em cada amostra, é necessário isolá-las e multiplicá-las in vitro.
Diferentes protocolos de isolamento e cultivo de CTM do SCU já foram empregados com sucesso, todos envolvendo uma etapa inicial de separação de células mononucleares, por meio de gradiente de densidade Ficoll-Paque [1-4]. Apesar dos resultados positivos observados por esses grupos, muitos estudos relatam grandes dificuldades no cultivo e manutenção dessas células in vitro e outros relatam completo insucesso no isolamento e cultivo das mesmas [5-8].
Todos os protocolos de cultivo de CTM do SCU iniciam com uma etapa de isolamento de células mononucleares com gradiente de densidade Ficoll-Paque, que requer várias etapas de centrifugação e manipulação do SCU, o que aumenta o risco de contaminação do mesmo. Na tentativa de agilizar e tornar os procedimentos de isolamento de células mononucleares mais rápidos, vários métodos já foram testados, por exemplo, uso de poligeline, gel de hidroxietil amido e gelatina para retirada de células vermelhas. Apesar da eficácia desses procedimentos, a liberação desses produtos para uso clínico depende da aprovação dos órgãos reguladores em diversos países [9].
Além disso, esses procedimentos também envolvem várias etapas de manuseio que aumentam o risco de contaminação. Também já foram testados sistemas de filtração hermeticamente fechados e de fácil manuseio para concentrar células mononucleares, denominado SCF SYSTEM. Esse sistema mostrou-se mais eficiente e rápido na separação de células mononucleares quando comparada à técnica convencional, que utiliza gradiente de densidade Ficoll, porém a liberação desse sistema para uso clínico ainda requer estudos adicionais [10].
Em vista dessas dificuldades, nosso grupo desenvolveu um protocolo de cultivo de CTM do SCU a partir do isolamento de células nucleadas, presente no buff coat obtidas por meio de centrifugação sem gradiente de densidade Ficoll-Paque. Essas células correspondem a todas as células nucleadas presentes no SCU e não apenas às células mononucleares de baixa densidade, isoladas pelo gradiente de densidade Ficoll-Paque. Esse protocolo foi comparado ao procedimento convencional empregando centrifugação com gradiente de densidade Ficoll-Paque, para isolamento de células mononucleares.
MÉTODOS
Coleta do sangue de cordão umbilical
Foram coletadas 10 amostras de SCU de placentas de gestação a termo, de mulheres saudáveis, não fumantes, não etilistas, com faixa etária de 20 a 40 anos, independentemente da etnia, no Serviço de Obstetrícia do Hospital de Base da FUNFARME/FAMERP de São José do Rio Preto. As amostras foram coletadas após assinatura do termo de consentimento livre e esclarecido, pela mãe ou responsável, seguindo as regulamentações do Comitê de Ética da Instituição, conforme Parecer Nº 168/2005. O sangue foi coletado em seringas estéreis contendo heparina sódica (1000UI).
Processamento do sangue de cordão umbilical
As amostras de SCU foram diluídas em uma proporção de 1:1, em tampão fosfato (PBS) e submetidas a dois diferentes procedimentos para cultivo de células mesenquimais: a) Método sem gradiente de densidade Ficoll-Paque (d=1,077g/ml) (Amershan Pharmacia); b) Método com gradiente de densidade Ficoll-Paque, descritas a seguir:
a) Método sem gradiente de densidade Ficoll-Paque: As amostras de SCU foram transferidas para tubos de centrífugas de 15 mL e submetidas a centrifugação a 1000 rpm, por 10 minutos, para obtenção do buffy coat. O buffy coat contendo todas as células nucleadas presentes no SCU foi transferido para um novo tubo de centrífuga, lavado duas vezes com meio de cultura por meio de centrifugação a 1000 rpm, por 8 minutos. O número de células nucleadas foi estimado após contagem em câmara de Neubauer e a viabilidade celular determinada pelo método de exclusão pelo azul de Tripan.
b) Método com gradiente de densidade Ficoll-Paque: As amostras de SCU foram transferidas para tubos de centrífuga de 15 mL contendo solução de Ficoll-Paque e submetidas à centrifugação a 2000 rpm, por 30 minutos, para isolamento de células mononucleares de baixa densidade. As células mononucleares foram transferidas para novo tubo e lavadas duas vezes com meio de cultura, por meio de centrifugação a 2000 rpm, por 10 minutos, segundo protocolo descrito por Erices et al. [2]. A estimativa do número de células e a viabilidade seguiram o mesmo procedimento descrito para as células nucleadas.
Cultivo de células mesenquimais
As culturas de CTM foram iniciadas a partir de células nucleadas e células mononucleares. O isolamento das CTM foi possível devido à sua capacidade de adesão ao frasco, diferentemente das células hematopoéticas não aderentes, que são eliminadas da cultura durante os procedimentos de troca de meio. Os procedimentos de cultivo estão descritos a seguir:
a) Cultivo de CTM a partir das células nucleadas: As culturas foram iniciadas em frascos de 25cm2, a uma densidade de 1x107 células nucleadas/cm2. As células foram alimentadas com meio de cultura
a-MEM, suplementado com 20% soro fetal bovino, 1% antibiótico/antimicótico e 1% de glutamina. As culturas foram incubadas a 37ºC, em atmosfera umedecida contendo 5% de CO2. A primeira troca de meio foi realizada 24-48 horas após o início do cultivo, para eliminação das células não-aderentes. Posteriormente, o meio de cultura foi trocado a cada quatro dias e o crescimento celular avaliado diariamente em microscópio invertido. Quando as células atingiram 50-60% de confluência, foram subdividas, após tratamento com tripsina/EDTA (0,25%) (Gibco-BRL).
b) Cultivo de CTM a partir das células mononucleares: As culturas foram iniciadas em frascos de 25cm2, a uma densidade de 1,0x106 células mononucleares/cm2, seguindo os mesmos procedimentos descritos para as células mononucleares.
Caracterização citoquímica das células mesenquimais
As células aderentes foram submetidas à marcação citoquímica com fosfatase ácida (PA) e reativo ácido de Schiff (PAS), segundo o protocolo descrito por Erices et al. [3] com modificações.
RESULTADOS
As 10 amostras foram submetidas aos protocolos de isolamento de células nucleadas e mononucleares. Nos procedimentos de isolamento de células nucleadas (sem Ficoll), foram obtidas 2,0-13,0x107 (mediana = 2,35x107) células/cm2. Nos procedimentos de isolamento de células mononucleares (com Ficoll), foram obtidas de 3,7-15,7x106 (mediana = 7,2x107) células/cm2. Em todas as amostras cultivadas, foram observadas células aderentes 24 horas após o início do cultivo. Após a segunda semana de cultivo, a taxa de crescimento das culturas provenientes do isolamento com Ficoll decaiu até estagnarem por completo. Nas culturas provenientes do isolamento sem Ficoll, somente três amostras mantiveram o crescimento, formando focos confluentes de células. Essas culturas foram submetidas a várias etapas de tripsinização para espalhamento ou subdivisão e permaneceram em cultivo por períodos que variaram de dois a três meses.
As células no início do cultivo apresentaram morfologias fibroblastóides e epitelióides (Figura 1A). Após as subdivisões houve predominância de células fibroblastóides (Figura 1B) e, em alguns casos, presença de grandes células arredondadas e multinucleadas (Figura 1C). Durante a tripsinização, as células fibroblastóides desprenderam rapidamente do frasco, ao passo que as células arredondadas necessitaram de um período maior de exposição à tripsina para desprender do frasco. A caracterização citoquímica evidenciou células fibroblastóides PAS positiva e PA negativa e, células arredondadas, PA positiva e PAS negativa (Figura 2).
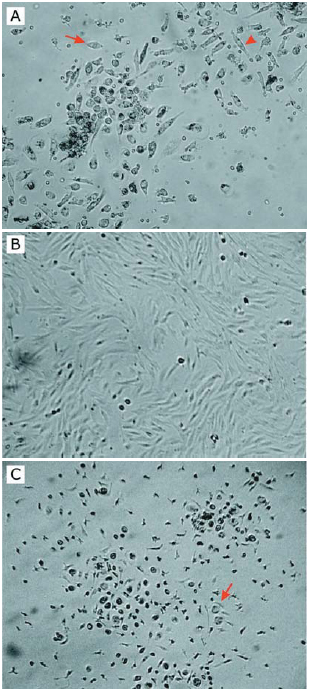
Fig. 1 - Fotomicrografia mostrando células aderentes provenientes do sangue de cordão umbilical. A. Células fibroblastóides (seta) e epitelióides (ponta de seta) observadas no início de cultivo. B. Células fibroblastóides confluentes. C. Células arredondadas (seta). Aumento 200x
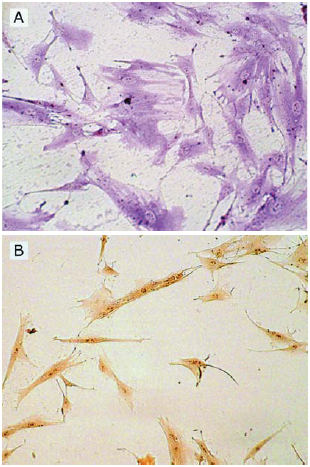
Fig. 2 - Fotomicrografia mostrando células aderentes provenientes do sangue de cordão umbilical. A. Análise citoquímica mostrando células mesenquimais marcadas positivamente pelo reativo ácido de Schiff (PAS). B. Análise citoquímica mostrando células mesenquimais marcadas negativamente pela fosfatase ácida. Aumento 200x
Nosso estudo investigou comparativamente o procedimento de isolamento e cultivo de células mesenquimais do sangue de cordão umbilical sem emprego do gradiente de densidade Ficoll-Paque. Esse procedimento, que possibilita a separação de todas as células nucleadas presentes no sangue de cordão umbilical, foi comparado à técnica padrão que emprega o gradiente de densidade Ficoll-Paque, que permite o isolamento seletivo das células mononucleares. Os resultados mostraram que, tanto células mononucleares quanto células nucleadas, isoladas do SCU, quando cultivadas in vitro, foram capazes de gerar células aderentes com diferentes morfologias. Dentre os tipos celulares observados estavam presentes células alongadas de aspecto fibroblastóide (spindle-shaped cells), células ovais similares às células epitelióides e células arredondadas semelhantes aos osteoclastos (osteoclast-like cells).
Diferentes estudos com sangue de cordão umbilical identificaram células semelhantes, cuja natureza foi determinada por meio de marcação citoquímica e imunocitoquímica. As células fibroblastóides (alongadas) mostraram-se positivas para marcadores de células mesenquimais e as células arredondadas positivas para marcadores de osteoclastos. A confirmação de que as células fibroblastóides correspondiam a CTM foi dada pela sua capacidade de diferenciação celular induzido por fatores de crescimento [2,4,11-14].
No presente estudo, as células aderentes foram caracterizadas citoquimicamente com PAS e PA. O PAS marca positivamente as células mesenquimais (fibroblastóides) e negativamente os osteoclastos (células arredondadas), ao passo que, PA marca positivamente os osteoclastos e negativamente as células mesenquimais. Os resultados obtidos associados à avaliação morfológica indicam que as células fibroblastóides correspondem às células mesenquimais, demonstrando que é possível isolar e cultivar essas células a partir do sangue de cordão umbilical, sem uso do gradiente de densidade Ficoll-Paque.
Embora no presente estudo não tenham sido empregados marcadores específicos de CTM e indução de diferenciação celular para confirmação da presença de CT, a intensa proliferação celular observada nas três amostras é um indicativo da presença de células-tronco. Isto porque, células diferenciadas ou senescentes possuem um tempo de vida limitado, caracterizado pela perda da capacidade de proliferação e alteração da morfologia, levando à estagnação da cultura [15].
A taxa de sucesso no isolamento e cultivo de células mesenquimais do SCU observada em nosso estudo foi de 30% (n=3/10), esses dados são condizentes com os achados da literatura [2,4,11-14]. A principal dificuldade no cultivo de CTM do SCU é decorrente da pequena quantidade de CTM presente em cada amostra. Segundo Goodwin et al. [1], apenas cerca de 0,05 a 2,8 por 106 células mononucleares semeadas correspondem a CTM. Além disso, a sobrevivência ou morte dessas células pode ser fortemente afetada por variações no tempo de armazenamento da amostra até o início de cultivo, quantidade de células mononucleares obtidas, presença de coágulo, hemólise, bem como pelas próprias condições de cultivo de cada laboratório [11,15].
Outro fator que dificulta a detecção das CTM in vitro é que essas células normalmente são detectadas após 2-4 semanas de cultivo, diferentemente do que é observado nas culturas de CTM da medula óssea ou de tecido adiposo, em que essas células são identificadas após 4-5 dias de cultivo [16]. No entanto, uma vez estabelecidas, as culturas de CTM do SCU são capazes de gerar muito mais células progenitoras do que as da medula óssea [15]. Isso é decorrente da imaturidade das células do recém-nascido quando comparada às células do adulto. O envelhecimento está associado à diminuição do tempo de vida das CTM e à sua capacidade de diferenciação [17].
Essas dificuldades são responsáveis por alguns pesquisadores serem sépticos quanto à presença de CTM no SCU [5-8]. No entanto, inúmeros estudos têm comprovado a presença de CTM no SCU, seu potencial de diferenciação e proliferação celular, mostrando que o SCU pode ser uma importante fonte de células empregadas em terapias celulares para tratamento de doenças tidas com incuráveis [1-4,11-20].
CONCLUSÃO
O procedimento de obtenção de células nucleadas sem uso do gradiente de densidade Ficoll-Paque mostrou-se mais eficiente para o cultivo de CTM do SCU quando comparado ao procedimento com emprego do gradiente de densidade Ficoll-Paque. A possibilidade de isolar e cultivar células mesenquimais sem uso de Ficoll, que é sabidamente tóxico, tornou o procedimento mais seguro e rápido. Esses resultados são preliminares e requerem mais estudos para validação do mesmo.
AGRADECIMENTOS
Este trabalho foi realizado com apoio financeiro da BAP (Bolsa de Auxílio ao Pesquisador) e da Braile Biomédica Indústria, Comércio e Representações SA.
REFERÊNCIAS
1. Goodwin HS, Bicknese AR, Chien SN, Bogucki BD, Quinn CO, Wall DA. Multilineage differention activity by cells isolated from umbilical cord blood: expression of bone, fat, and neural markers. Biol Blood Marrow Transplant. 2001;7(11):581-8. [
MedLine]
2. Erices A, Conget P, Minguell JJ. Mesenchymal progenitor cells in human umbilical cord blood. Br J Haematol. 2000;109(1):235-42. [
MedLine]
3. McGuckin CP, Forraz N, Allouard Q, Pettengell R. Umbilical cord blood stem cells can expand hematopoietic and neuroglial progenitors in vitro. Exp Cell Res. 2004;295(2):350-9. [
MedLine]
4. Park KS, Lee YS, Kang KS. In vitro neuronal and osteogenic differentiation of mesenchymal stem cells from human umbilical cord blood. J Vet Sci. 2006;7(4):343-8. [
MedLine]
5. Wexler SA, Donaldson C, Denning-Kendall P, Rice C, Bradley B, Hows JM. Adult bone marrow is a rich source of human mesenchymal 'stem' cells but umbilical cord and mobilized adult blood are not. Br J Haematol. 2003;121(2):368-74. [
MedLine]
6. Mareschi K, Biasin E, Piacibello W, Aglietta M, Madon E, Fagioli F. Isolation of human mesenchymal stem cells: bone marrow versus umbilical cord blood. Haematologica. 2001;86(10):1099-100. [
MedLine]
7. Romanov YA, Svintsitskaya VA, Smirnov VN. Searching for alternative sources of postnatal human mesenchymal stem cells: candidate MSC-like cells from umbilical cord. Stem Cells. 2003;21(1):105-10. [
MedLine]
8. Yu M, Xiao Z, Shen L, Li L. Mid-trimester fetal blood-derived adherent cells share characteristics similar to mesenchymal stem cells but full-term umbilical cord blood does not. Br J Haematol. 2004;124(5):666-75. [
MedLine]
9. Perutelli P, Catellani S, Scarso L, Cornaglia-Ferraris P, Dini G. Processing of human cord blood by three different procedures for red blood cell depletion and mononuclear cell recovery. Vox Sang. 1999;76(4):237-40. [
MedLine]
10. Yasutake M, Sumita S, Terashima S, Tokushima Y, Nitadori Y, Takahashi TA. Stem cell collection filter system for human placental/umbilical cord blood processing. Vox Sang. 2000;80(2):101-5.
11. Gang EJ, Hong SH, Jeong JA, Hwang SH, Kim SW, Yang IH, et al. In vitro mesengenic potential of human umbilical cord blood-derived mesenchymal stem cells. Biochem Biophys Res Commun. 2004;321(1):102-8. [
MedLine]
12. Hong SH, Gang EJ, Jeong JA, Ahn C, Hwang SH, Yang IH, et al. In vitro differentiation of human umbilical cord blood-derived mesenchymal stem cells into hepatocyte-like cells. Biochem Biophys Res Commun. 2005;330(4):1153-61. [
MedLine]
13. Chang YJ, Tseng CP, Hsu LF, Hsieh TB, Hwang SM. Characterization of two populations of mesenchymal progenitor cells in umbilical cord blood. Cell Biol Int. 2006;30(6):495-9. [
MedLine]
14. Kang XQ, Zang WJ, Bao LJ, Li DL, Xu XL, Yu XJ. Differentiating characterization of human umbilical cord blood-derived mesenchymal stem cells in vitro. Cell Biol Int. 2006;30(7):569-75. [
MedLine]
15. Bieback K, Kern S, Klüter H, Eichler H. Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood. Stem Cells. 2004;22(4):625-34. [
MedLine]
16. Kern S, Eichler H, Stoeve J, Klüter H, Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 2006;24(5):1294-301. [
MedLine]
17. Stenderup K, Justesen J, Clausen C, Kassem M. Aging is associated with decreased maximal life span and accelerated senescence of bone marrow stromal cells. Bone. 2003;33(6):919-26. [
MedLine]
18. Gang EJ, Jeong JA, Hong SH, Hwang SH, Kim SW, Yang IH, et al. Skeletal myogenic differentiation of mesenchymal stem cells isolated from human umbilical cord blood. Stem Cells. 2004;22(4):617-24. [
MedLine]
19. Wagner W, Wein F, Seckinger A, Frankhauser M, Wirkner U, Krause U. Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood. Exp Hematol. 2005;33(11):1402-16. [
MedLine]
20. Lee MW, Choi J, Yang MS, Moon YJ, Park JS, Kim HC, et al. Mesenchymal stem cells from cryopreserved human umbilical cord blood. Biochem Biophys Res Commun. 2004;320(1): 273-8. [
MedLine]


 All scientific articles published at bjcvs.org are licensed under a Creative Commons license
All scientific articles published at bjcvs.org are licensed under a Creative Commons license