INTRODUÇÃO
A terapia celular tem sido utilizada na reparação de área fibrosada, conseqüente a infarto do miocárdio (IM) e diferentes tipos de células têm sido testadas [1]. A cardiomioplastia celular tem buscado a recuperação da função do órgão por meio de duas linhas de pesquisa: células para a miogênese e células para angiogênese cardíaca [2-4].
Para a primeira, têm sido utilizadas as células de músculo liso, progenitoras adultas multipotenciais de medula óssea, os mioblastos esqueléticos e os cardiomiócitos fetais e neonatais. Para a angiogênese cardíaca, têm sido empregadas as células endoteliais retiradas da camada íntima das artérias ou veias, tronco derivadas da medula óssea e progenitoras derivadas do sangue circulante [5].
Estas células foram individualmente injetadas ou em associação, em diferentes tipos de animais de experimentação [6-9] e em séries clínicas [10,11], com miocardiopatia isquêmica [12] ou dilatada [13].
Nesse trabalho é proposta uma nova opção para a miocardioplastia celular, em animais de laboratório com fração de ejeção de ventrículo esquerdo menor que 40%, causada por miocardiopatia isquêmica.
Foram utilizadas nesse estudo células tronco mesenquimais de medula óssea (CTM) e células mioblásticas esqueléticas (ME) cultivadas isoladamente ou em co-cultura, transplantadas ou co-transplantadas. Foi avaliada a resposta funcional por meio do ecocardiograma bidimensional, que permitiu medir as frações de ejeções do ventrículo esquerdo (FEVE), em dois momentos do seguimento, e analisados os estudos imunocitoquímicos in vitro e após a eutánasia, e histopatológicos das espécimes cardíacas com um mês da cardiomioplastia.
MÉTODO
Todos os experimentos foram realizados de acordo com os princípios de cuidados com animais de laboratório de acordo com a lei nº 6638 da República Federativa do Brasil que trata de normas para a prática didático-científica da vivissecção de animais [14].
O modelo utilizado para o desenvolvimento da miocardiopatia isquêmica foi por meio da ligadura da artéria coronariana e conseqüente infarto do miocárdio.
Os animais de laboratório empregados foram ratos Wistar, machos com peso entre 250 e 300 gramas. O infarto do miocárdio foi causado, sob anestesia geral, com os animais intubados, ventilados por aparelho respiratório (Harvard Apparatus, USA) por meio de toracotomia lateral esquerda. Após a exposição do coração, a artéria coronária interventricular anterior foi ligada, entre o átrio esquerdo e a via de saída do ventrículo direito com fio de polipropileno 7,0 (Ethicon, USA).
O transplante celular ou a injeção do meio de cultura foi realizado por meio de esternotomia mediana, após sete dias do IM, em uma única injeção sob a mesma técnica anestésica e ventilatória.
Avaliação Ecocardiográfica
Os animais foram analisados com equipamento de ecocardiografia bidimensional modelo Sonos 5500 (Hewlet Packard, USA), com transdutores setorial S12 (5-12 mHz) e limiar 15L6 (7-15mHz) e a fração de ejeção do ventrículo esquerdo (FEVE) foi medida na posição para-esternal longitudinal, de acordo com o método de Simpson, com os animais sob anestesia geral.
Método de Cultura Celular
A obtenção das células foi realizada por duas diferentes maneiras, de acordo com o tipo celular.
1) Células esqueléticas mioblásticas
Limpeza e maceração muscular
O músculo tibial anterior foi retirado dos animais em uma câmara de fluxo laminar e foram colocados em uma placa com meio de cultura, com antibiótico a 1% (penicilina 100 U/ml e estreptomicina 100 µg/ml). A seguir, com auxílio de uma lupa, foram retirados os vasos e os tecidos conjuntivos: aponeuroses e tecidos gordurosos e os fragmentos colocados em outra placa e segue-se a maceração.
Digestão enzimática
O botão de células do músculo foi diluído em Colagenose tipo IA (Sigma, USA) por uma hora, em incubadora de CO2 a 5% e a 37º C de temperatura e agitado a cada 10 minutos.
As células foram centrifugadas, o botão de células foi recuperado em tripsina - EDTA a 0,25% (Gibco, USA) em incubadora. A digestão enzimática foi interrompida com soro fetal bovino (Gibco, USA).
Filtração e semeadura
O material foi filtrado e centrifugado, o botão de células recuperado e diluído em de meio de cultura DMEN (Dulbecco's Modified Eagle's Medium), suplementado com 15% de soro fetal bovino, 1% de antibiótico e 10% de IGF-I (fator de crescimento de insulina tipo I) e 10-7 M de dexametaxona. A contagem das células foi realizada com auxílio da câmara de Neubauer.
As células foram cultivadas em média por 14 dias em meio de cultura e mantidas em estufa de CO2 a 5% e a 37ºC de temperatura. O meio foi trocado duas a três vezes por semana e realizadas as subculturas de acordo com a confluência celular.
2) Células mononucleares da medula óssea
A coleta celular foi realizada por meio da técnica de punção e aspiração.
Coleta das células
Sob anestesia geral o animal foi colocado em decúbito lateral com o membro posterior em flexão, a punção da crista ilíaca foi realizada com uma seringa de 5ml heparinizada (liquemine 5000U/ml) com agulha 25x8, 21G1 para aspiração. O material coletado foi processado utilizando-se um gradiente de densidade, Ficoll-Hipaque (d=1,077) de acordo como descrito por BOYUM, em 1968 [15]. Após 48 horas, o sobrenadante da cultura (linha hematopoética e debris) foi aspirado, restando aderidas as CTM. Foi realizada a contagem das células mononucleares da medula óssea com auxílio de câmara de Neubauer. O método de cultura foi semelhante com todas as células [16].
Co-Cultura
Após o isolamento celular conforme técnicas descritas acima, as células ME e as células mononucleares foram distribuídas em proporções de 2:1 e realizadas observações morfológicas, quanto à sobrevivência, à adesão ao substrato e à confluência. Após 48h, o sobrenadante da cultura (linha hematopoética e debris) foi aspirado dos frascos, restando aderidos apenas os ME, as CTM e os fibroblastos. As células foram cultivadas da maneira já descrita acima [17].
Grupo de experimentação
Setenta e dois ratos foram incluídos neste estudo e divididos em quatro grupos, de acordo com o meio de cultura ou das células injetadas: grupo controle em que foi injetado apenas o meio de cultura (22 ratos); grupo CTM (17 ratos), nos quais foram injetadas 2,5 x 106 células, grupos células ME (16 ratos) nos quais foram injetadas 5 x 106 células e grupo células em co-cultura (17 ratos) nos quais foram injetadas 7,5 x 106 células.
Estudos imunocitoquímicos e histopatológicos
Durante a cultura in vitro, as células foram marcadas com anti-vimentiva para confirmar a presença de células CTM e com anti-desmina para as células musculares e nas espécimes, as células foram identificadas com os marcadores já descritos e acrescido do anti-miosina rápida que é um especifico para ME.
Nos estudos histopatológicos realizados após a eutanásia dos animais (1 mês de seguimento), os cortes foram coradas com Tricrômio de Gomori e os achados foram interpretados por microscopia óptica.
Análise Estatística
Os quatro grupos foram comparados entre si e individualmente, em relação à FEVE, com uma semana após o IM e um mês após a injeção celular. Utilizou-se o teste ANOVA, o teste t de Student para amostras pareadas e o teste exato de Fisher, considerando-se diferença estatística significante quando p<0,05.
RESULTADOS
Análise da função ventricular
Fração de ejeção do ventrículo esquerdo
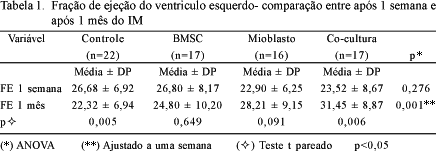
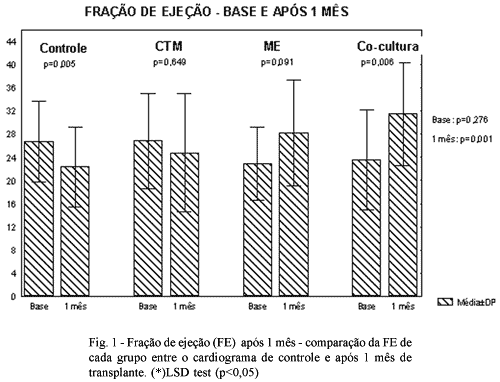
Na comparação das FEVE médias dos grupos no ecocardiograma de controle não se encontrou diferença estatística (p=0,276).
Na avaliação ecocardiográfica com um mês após a injeção, foi encontrada diferença estatística significativa entre a fração de ejeção média dos grupos (p=0,001). Essa diferença ocorreu entre o grupo controle e o grupo ME (p=0,037), entre o grupo controle e o grupo em co-cultura (p<0,001) e entre o grupo CTM e o grupo em co-cultura (p=0,025). Não se encontrou diferença estatística entre o grupo controle e o grupo CTM (p=0,372), entre o grupo ME e o grupo CTM (p=0,263) e o grupo ME e o grupo em co-cultura (p=0,267).
Quando comparamos as medidas, em cada grupo, entre os dois ecocardiogramas encontrou-se diferença significativa no grupo controle (p=0,005) e no grupo em co-cultura (p=0,006) e não foi encontrada essa diferença no grupo CTM (0,65) e ME (0,09).
Os resultados obtidos em relação à fração de ejeção são apresentados nas Tabelas 1 e 2 e na Figura 1.
Estudo imunocitoquímico
No estudo inumocitoquímico in-vitro, identificou-se CTM quando se marcou com anti-vimentiva e células musculares, com anti-desmina.
Na avaliação em espécimes após um mês do transplante, identificaram-se células musculares quando se marcou com anti-desmina e ME quando se marcou com anti-miosina rápida.
Estudo histopatológico
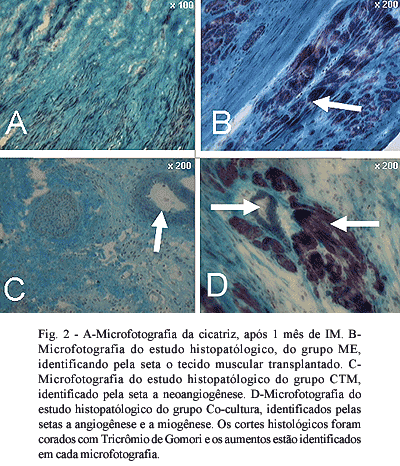
Na interpretação dos cortes corados com Tricrômio de Gomori, identificou-se tecido muscular no grupo em que essas células foram injetadas. No grupo em que se injetou CTM, identificou-se exclusivamente angiogênese, na zona do IM. No grupo co-cultura identificou-se angiogênese e miogênese na área de fibrose do VE (Figura 2).
COMENTÁRIOS
A insuficiência cardíaca é determinada, entre outras causas, pela miocardiopatia isquêmica [18]. O uso da terapêutica medicamentosa, da angioplastia percutânea ou da operação de revascularização do miocárdio com enxertos vasculares, tem sido adotado para aliviar sintomas ou recuperar a oferta de nutrientes em área isquêmica sem, no entanto, regenerar os cardiomiócitos definitivamente lesados e responsáveis pelo comprometimento da função contrátil do coração [19].
O transplante cardíaco tem sido, até o momento, o único tratamento operatório que trata a causa e não o efeito da lesão das células cardíacas uma vez que o órgão é substituído. Entretanto, é limitado pelo pequeno número de doadores e o difícil seguimento pós-operatório [20].
Com o conhecimento da biologia molecular e celular, a terapia celular tem sido usada em diferentes doenças que, até então, eram intratáveis e incuráveis [21]. A terapia celular direcionada para o coração iniciou-se nos anos 90, com a utilização experimental de cardiomiócitos fetais, evoluindo para a utilização de ME e de CTM [22,23].
Tem-se buscado a recuperação da oferta de nutrientes e metabólicos através da angiogênese e de massa muscular através da miogênese. No início dos anos 2000, iniciou-se a utilização em séries clínicas e quem primeiro descreveu a utilização de ME na opção de recuperação da função contrátil do coração foi MENASCHÉ et al., em 2001 [10].
O estudo desenvolvido na PUCPR baseou-se na idéia de buscar sinergismos entre as células durante a cultura e de ofertar duas células diferentes na recuperação da cicatriz do IM, com o objetivo de desenvolver novos vasos para a perfusão e também massa muscular e com isso buscar, provavelmente, diminuir a alta mortalidade dessas células injetadas em área com baixa oferta de nutrientes e metabólicos, conforme tem sido descrito na literatura [1].
Desta forma, utilizou-se CTM e ME, sendo que a primeira tem o objetivo de angiogênese e a segunda, de miogênese.
Os achados imunocitoquímicos in vitro e nas espécimes cardíacas obtidas após um mês do transplante confirmaram a presença das células cultivadas em laboratório isoladamente e em co-cultura.
Nos estudos histopatológicos também realizados neste período, foram encontrados novos vasos no grupo em que se injetou CTM, células musculares no grupo ME e angiogênese e miogênese no grupo em que se transplantaram as duas células co-cultivadas.
Na análise da função de ejeção do VE, não se observou diferença estatística nas medidas obtidas do ecocardiograma controle entre os quatro grupos.
Na avaliação após um mês do transplante, encontrou-se diferença estatística entre os grupos. Na comparação entre esses, se observou diferença estatística entre o grupo controle e o grupo ME, entre o grupo controle e o grupo em co-cultura e o grupo CTM e o grupo em co-cultura o que permite inferir que nos grupos transplantados com células musculares isoladas ou em co-cultura ocorre melhora da função cardíaca.
Em cada grupo, na comparação entre as duas avaliações, observou-se diferença estatística no grupo controle para pior e no grupo co-cultura para melhor. No grupo CTM e no grupo ME não ocorreu diferença estatística, apesar da fração de ejeção ter aumentado neste último grupo.
CONCLUSÃO
Os achados ecocardiográficos, imunocitoquímicos e histopatológicos permitiram concluir que:
* a fração de ejeção do VE, melhorou exclusivamente nos grupos em que se transplantaram células musculares isoladas ou em co-cultura e que no grupo co-cultura a recuperação dessa medida foi a mais significativa entre os grupos utilizados neste estudo.
* durante o co-cultivo tem-se a presença das duas células (TMC e ME), que os diferentes tipos de células foram encontrados isoladamente ou em conjunto de acordo com as células injetadas e que no grupo CTM, encontraram-se apenas novos vasos, no grupo ME, apenas células musculares e no grupo co-cultura, a presença de angiogênese e miogênese.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Menasche P. Cell transplantation in myocardium. Ann Thorac Surg 2003,75(6 suppl):S20-8.
2. Taylor DA, Atkins BZ, Hungspreugs P, Jones TR, Reedy MC, Hutcheson KA et al. Regenerating functional myocardium: improved performance after skeletal myoblast transplantation. Nat Med 1998;4:929-33.
[ Medline ]
3. Kocher AA, Schuster MD, Szabolcs MJ, Takuma S, Burkhoff D, Wang J et al. Neovascularization of ischemic myocardium by human bone-marrow derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function. Nat Med 2001;7:430-6.
[ Medline ]
4. Kim EJ, Li RK, Weisel RD, Mickle DA, Jia ZQ, Tomita S et al. Angiogenesis by endothelial cell transplantation. J Thorac Cardiovasc Surg 2001;122:963-71.
[ Medline ]
5. Cardoso F, Gonçalez JH, Ezquerra. Pespectivas futuras de tratamento em la insuficiência cardíaca: utilización de células madre para la regeneración miocárdica. Rev Arg Cir Cardiovasc 2003;1:15-24.
6. Li RK, Jia ZQ, Weisel RD, Mickle DA, Zhang J, Mohabeer MK et al. Cardiomyocyte transplantation improves heart function. Ann Thorac Surg 1996;62:654-61.
[ Medline ]
7. Tomita S, Mickle DA, Weisel RD, Jia ZQ, Tumiati LC, Allidina Y et al. Improved heart function with myogenesis and angiogenesis after autologous porcine bone marrow stromal cell transplantation. J Thorac Cardiovasc Surg 2002;123:1132-40.
[ Medline ]
8. Strauer BE, Brehm M, Zeus T, Kostering M, Hernandez A, Sorg RV et al. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 2002;106:1913-8.
9. Ghostine S, Carrion C, Souza LC, Richard P, Bruneval P, Vilquin JT et al. Long-term efficacy of myoblast transplantation on regional structure and function after myocardial infarction. Circulation 2002;106(suppl 1):I131-6.
10. Menasche P, Hagege AA, Scorsin M, Pouzet B, Desnos M, Duboc D et al. Myoblast transplantation for heart failure. Lancet 2001;357:279-80.
11. Perin EC, Dohmann HF, Borojevic R, Silva SA, Sousa AL, Mesquita CT et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation 2003;107:2294-302.
12. Assmus B, Schachinger V, Teupe C, Britten M, Lehmann R, Dobert N et al. Transplantation of Progenitor Cells and Regeneration Enhancement in Acute Myocardial Infarction (TOPCARE-AMI). Circulation 2002;106:3009-17.
13. Soares MB, Lima RS, Rocha LL, Takyia CM, Pontes-de-Carvalho L, de Carvalho AC et al. Transplanted bone marrow cells repair heart tissue and reduce myocarditis in chronic chagasic mice. Am J Pathol 2004;164:441-7.
[ Medline ]
14. Brasil. Lei Federal n.? 6.638. Estabelece normas para a prática didático-científica da vivissecção de animais e determina outras providências. Diário Oficial da União, Brasília, p.1, 10 de maio de 1979.
15. Boyum A. Isolation of mononuclear cells and granulocytes from human blood: isolation of monuclear cells by one centrifugation, and of granulocytes by combining centrifugation and sedimentation at 1 g. Scand J Clin Lab Invest Suppl 1968;97:77-89.
16. Carvalho KA, Guarita-Souza LC, Rebelatto CL, Senegaglia AC, Hansen P, Mendonça JG et al. Could the coculture of skeletal myoblasts and mesenchymal stem cells be a solution for postinfarction myocardial scar? Transplant Proc 2004;36:991-2.
[ Medline ]
17. Carvalho KA, Guarita-Souza LC, Rebelatto CL, Senegaglia AC, Hansen P, Mendonca JG et al. Aneural culture of rat myoblasts of myocardial transplant. Transplant Proc 2004;36: 1023-4.
[ Medline ]
18. Pfeffer MA. Left ventricular remodeling after acute myocardial infarction. Annu Rev Med 1995; 46:455-66.
[ Medline ]
19. Ryan TJ, Antman EM, Brooks NH, Califf RM, Hillis LD, Hiratzka LF et al. 1999 update: ACC/AHA guidelines for management of patients with acute myocardial infarction: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee on Management of Acute Infarction) J Am Coll Cardiol 1999;34:890-911.
[ Medline ]
20. Bocchi EA, Fiorelli A; First Guideline Group for Heart Transplantation of the Brazilian Society of Cardiology. The Brazilian experience with heart transplantation: a multicenter report. J Heart Lung Transplant 2001;20:637-45.
[ Medline ]
21. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999;284:143-7.
[ Medline ]
22. Scorsin M, Hagege A, Vilquin JT, Fiszman M, Marotte F, Samuel JL et al. Comparison of the effects of fetal cardiomyocyte and skeletal myoblast transplantation on postinfarction left ventricular function. J Thorac Cardiovasc Surg 2000;119:1169-75.
[ Medline ]
23. Brofman PRS, Carvalho K, Guarita-Souza LC. Cell transplantation: a new option for treating cardiomyopathy. Prog Biomed Res 2003;8:67-8.

 All scientific articles published at bjcvs.org are licensed under a Creative Commons license
All scientific articles published at bjcvs.org are licensed under a Creative Commons license